
| A. | 单位时间里每增加1molN2,同时减少2molNH3 | |
| B. | c(N2):c(H2):c(NH3)=1:1:1 | |
| C. | N2与H2的物质的量与NH3的物质的量相等 | |
| D. | N2、H2和NH3的质量分数不再改变 |
分析 化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,由此衍生的一些物理量不再变化,注意反应化学方程式中气体的化学计量数之和前后不等的特点,以此判断.
解答 解:A、无论反应是否达到平衡状态,只要单位时间里每增加1molN2,同时减少2molNH3,所以不能用来判断该反应达到平衡状态,故A错误;
B、c(N2):c(H2):c(NH3)=1:1:1,不能用来判断是否达到平衡状态,达到平衡状态时,各组分的浓度不再变化,故B错误;
C、N2与H2的物质的量与NH3的物质的量相等,不一定是平衡状态,故C错误.
D、N2、H2和NH3的质量分数不再改变,说明达到平衡状态,故D正确.
故选D.
点评 本题考查化学平衡状态的判断,题目难度不大,注意方程式中气体的化学计量数关系,注意平衡时的浓度关系、物质的量关系不能作为判断是否平衡的依据.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
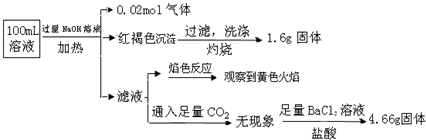
| A. | 原溶液中c(Fe3+)=0.2 mol•L-1 | |
| B. | SO42ˉ、NH4+、Na+一定存在,CO32ˉ、Al3+一定不存在 | |
| C. | 溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol•L-1 | |
| D. | 取少量原溶液于试管中,加入KSCN溶液,溶液成血红色,说明该溶液一定没有Fe2+,只有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
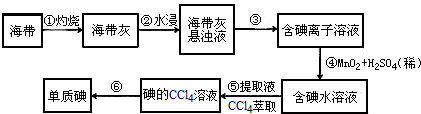
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤燃烧时,化学能主要转化为热能 | |
| B. | 白炽灯工作时,电能转化为光能 | |
| C. | 电解水生成氢气和氧气时,化学能转化为电能 | |
| D. | 绿色植物进行光合作用时,太阳能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径:r(Na+)>r(Mg2+)>r(Al3+) | B. | 酸性强弱:HClO>H2SO3>H3PO4 | ||
| C. | 稳定性:HF>H2O>H2S | D. | 碱性强弱:Pb(OH)4>Sn(OH)4>Ge(OH)4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
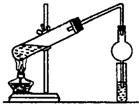 某同学用乙醇、乙酸和浓硫酸制取乙酸乙酯,装置如图所示.
某同学用乙醇、乙酸和浓硫酸制取乙酸乙酯,装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
| 平行实验次数 | 1 | 2 | 3 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
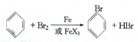
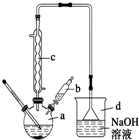 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com