
【题目】下列物质中,不属于合金的是( )
A.硬铝
B.水银
C.黄铜
D.钢铁
科目:高中化学 来源: 题型:
【题目】CO、CO2是化石燃料燃烧的主要产物。
(1)将含002molCO2和001molCO的混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃,充分反应后,固体质量增加______g。
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol,键能Eo-o=499.0kJ/mol。
①反应:CO(g)+O2(g)![]() CO2(g)+O(g)的△H=______kJ/mol。
CO2(g)+O(g)的△H=______kJ/mol。
②已知2500K时,①中反应的平衡常数为0.40,某时刻该反应体系中各物质浓度满足:c(CO)·c(O2)=c(CO2) ·c(O),则此时v(正)_____(填“>""<"或"=”)v(逆)。
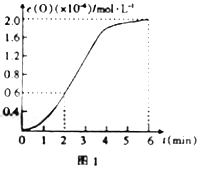
③已知1500℃时,在密闭容器中发生反应:CO2(g)![]() CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1所示,则0~2min内,CO2的平均反应速率v(CO2)=______。
CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1所示,则0~2min内,CO2的平均反应速率v(CO2)=______。
(3)在某密闭容器中发生反应:2CO2(g)![]() 2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图2所示。
2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图2所示。
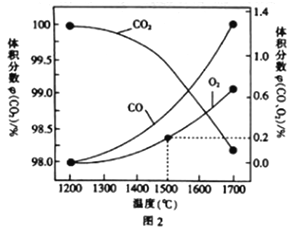
①恒温恒容条件下,能表示该可逆反应达到平衡状态的有___(填字母).
A.CO的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内,消耗CO的浓度等于生成CO2的浓度
②分析图2,若1500℃时反应达到平衡状态,且容器体积为1L,则此时反应的平衡常数K=____(计算结果保留1位小数)。
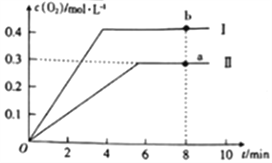
③向2L的恒容密闭容器中充入2molCO2(g),发生反应:2CO2(g)![]() 2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是______;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)_____(填“>”“<”或“=”)vb(CO)。
2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是______;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)_____(填“>”“<”或“=”)vb(CO)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质的转化关系如图所示。
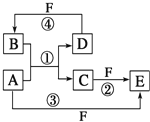
(1)若 A 为短周期金属单质,D 为短周期非金属单质,且所含元素的原子序数 A 是 D 的 2 倍,所含元素的原子最外层电子数 D 是 A 的 2 倍,F 的浓溶液与 A、D 反应都有红棕色气体生成。请写出以下物 质的化学式:B_____F_____;反应④的化学方程式为_____.
(2)若 A 是常见的变价金属的单质,D、F 是气态单质,且反应①在水溶液中进行。反应②也在水溶液 中进行,其离子方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①检测乙醇中是否含有水可加入少量的无水硫酸铜,若变蓝则含水 ②除去乙醇中微量的水可加入金属钠,使其完全反应 ③获得无水乙醇的方法是直接加热蒸馏 ④乙酸与乙醇酯化反应时断裂碳氧键
A.①③B.②④C.①④D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1mol/L的氨水中逐滴滴加0.1mol/L的盐酸,溶液中pH与pOH[pOH=-lgc(OH-)]的变化关系如右图所示。下列说法正确的是
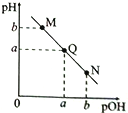
A. M点:(pH+pOH) >2a
B. N点溶液加水稀释, 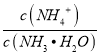 增大
增大
C. M、N两点的溶液中:[cM(NH4+)-cN(C1-)] <[cM(Cl-)-cN(NH4+)]
D. 线段MN上各点所示溶液中水的电离程度最大的不是Q点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】清末成书的《化学鉴原》中有一段描述:“各原质(元素)化合所用之数名曰`分剂数'。养气(氧气)以八分为一分剂(即分剂数为八),……一分剂轻气(氢气)为一,……并之即水,一分剂为九”。其中与“分剂数”一词最接近的现代化学概念是( )
A. 摩尔质量 B. 物质的量 C. 化合价 D. 质量分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为部分元素在元素周期表中的相对位置。据此回答相关问题:
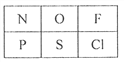
(1)其中非金属性最强的是__________(填元素符号)。
(2)P、S两种元素的最高价氧化物对应的水化物的酸性:H3PO4________H2SO4(填“>”、“<”或“=”)
(3)N位于元素周期表中的第___________族。
(4)F、Cl两种元素氢化物的稳定性:HF_______HCl(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z 四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是
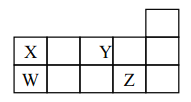
A. 四种元素中原子半径最大为 W, Y 的氢化物稳定性最强
B. 四种元素最高价氧化物的水化物都是酸
C. XZ4、 WY2中所含化学键类型相同,熔点都很高
D. W、 X 形成的单质都是重要的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铁及其化合物在合金材料以及催化剂等方面应用广泛。
(1)Fe3+的电子排布式为___________________。已知,Fe3+的化学性质比Fe2+稳定,请从原子结构的角度进行解释_____________________________________________________。
(2)Fe能与CO形成配合物Fe(CO)5,1 mol Fe(CO)5中含有________ mol σ键
(3)与CO互为等电子体的分子和离子分别为_______和_______(各举一种即可,填化学式)
(4)已知某铁晶体的晶胞结构如图所示。
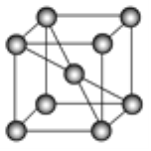
①该晶胞中含有铁原子的数目为___________。
②若晶胞的边长为a cm,则晶体铁的密度为_______________________g·cm-3(用代数式表示,阿伏加德罗常数为NA)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com