
| A.172.5kJ | B.1149kJ | C.517.5kJ | D.283kJ |


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.②④ | C.②③ | D.①④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题


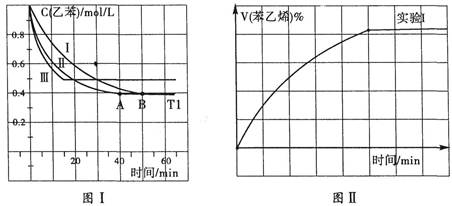
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


| A.升高温度 | B.增大压强 |
| C.增大H2O(g)的浓度 | D.减少CO2(g)的浓度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2P2O5(s);ΔH1,
2P2O5(s);ΔH1, 2P2O5(s);ΔH2,则ΔH1和ΔH2的关系正确的是
2P2O5(s);ΔH2,则ΔH1和ΔH2的关系正确的是| A.ΔH1=ΔH2 | B.ΔH1<ΔH2 | C.ΔH1>ΔH2 | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a < b | B.a = b |
| C.a > b | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.吸收183KJ | B.吸收248KJ | C.放出183KJ | D.放出366KJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-2491 kJ·mol-1 | B.+859 kJ·mol-1 |
| C.-1403 kJ·mol-1 | D.-859 kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com