
如图所示是298 K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是( ) 
A.该反应的热化学方程式为:N2+3H2 2NH3 ΔH=-92 kJ/mol 2NH3 ΔH=-92 kJ/mol |
| B.a曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热改变 |
| D.在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1 |
D
解析试题分析:A、热化学方程式没有注明物质状态,错误;B、催化剂能降低反应的活化能,既过渡态的平均能量(图中曲线峰值)低,b曲线才是加入催化剂时的能量变化曲线,错误;C、催化剂只改变反应途径,反应物和生成物均不改变,则生成物能量总和与反应物能量总和不变,其差值ΔH(反应热)也不变,错误;D、在温度、体积一定的条件下,①通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,②通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,②相当于在①的基础上加压至原来的2倍,平衡正向移动,所以Q2>2Q1,又因为是可逆反应,反应物没有完全转化为生成物,所以184>Q2,综上所述,则184>Q2>2Q1,正确。
考点:考查热化学方程式、催化剂对化学反应的影响、可逆反应特征、等效平衡、反应热大小比较等。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:单选题
下列说法错误的是
| A.由单质A转化为单质B,ΔH=+119kJ/mol,可知单质A比单质B稳定 |
| B.灼热的碳与CO2反应既是氧化还原反应,又是生成物总能量高于反应物总能量的反应 |
| C.决定化学反应速率的根本因素是参加反应的各物质的结构和性质 |
| D.对于一个可逆反应(ΔH<0)达到平衡后,升高温度可以增加活化分子的百分数,提高有效碰撞的次数,使V正增大的倍数大于V逆增大的倍数,从而使化学反应平衡逆向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在同温同压下,下列各组热化学方程式中,△H2>△H1的是
| A.S(g)+O2(g)=SO2(g),△H1; S(s)+O2(g)=SO2(g),△H2 |
| B.2H2(g)+O2(g)=2H2O(g),△H1; 2H2(g)+O2(g)=2H2O(l),△H2 |
C.C(s)+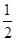 O2(g)=CO(g)△H1;C(s)+O2(g)=CO2(g) △H2 O2(g)=CO(g)△H1;C(s)+O2(g)=CO2(g) △H2 |
| D.H2(g)+Cl2(g)=2HCl(g),△H1; 2H2(g)+2Cl2(g)=4HCl(g),△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在298 K、100 kPa时,已知:
① 2H2O(g)=O2(g)+2H2(g) ΔH1 ② Cl2(g)+H2(g)=2HCl(g) ΔH2
③ 2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是( )
| A.ΔH3=ΔH1+2ΔH2 | B.ΔH3=ΔH1+ΔH2 | C.ΔH3=ΔH1-2ΔH2 | D.ΔH3=ΔH1-ΔH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
关于下图,下列说法不正确的是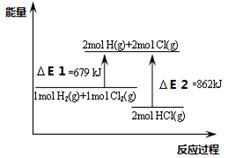
| A.△E2是2mol HCl(g)的总键能 |
| B.该反应的热化学方程式为:H2(g)+Cl2(g)=2HCl(g)△H =-183KJ.mol-1 |
| C.通常情况下H2与Cl2混和不会反应 |
| D.该反应是一个吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:P4(g)+6Cl2(g)=4PCl3(g) △H=a kJ?mol—1、P4(g)+10Cl2(g)=4PCl5(g) △H=b kJ?mol—1
P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ?mol—1,PCl3中P-Cl键的键能为1.2c kJ?mol—1。下列叙述正确的是
| A.P-P键的键能大于P-Cl键的键能 |
| B.可求Cl2(g)+ PCl3(g)=4PCl5(s)的反应热△H |
| C.Cl-Cl键的键能为(b-a+5.6c)/4 kJ?mol—1 |
| D.P-P键的键能为(5a-3b+12c)/8 kJ?mol—1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法中,错误的是
| A.人类目前所直接利用的能量大部分是由化学反应产生的 |
| B.化学变化中的能量变化主要是由化学键变化引起的 |
| C.化学反应中能量变化的大小与反应物的质量多少无关 |
| D.能量变化是化学反应的基本特征之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知反应:H2(g) + 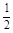 O2(g) = H2O(g) △H1
O2(g) = H2O(g) △H1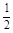 N2(g) + O2(g) = NO2 (g) △H2
N2(g) + O2(g) = NO2 (g) △H2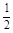 N2(g) +
N2(g) + 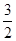 H2(g) = NH3 (g) △H3
H2(g) = NH3 (g) △H3
则反应2NH3 (g) +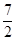 O2(g) =2NO2 (g) +3H2O(g) 的△H=
O2(g) =2NO2 (g) +3H2O(g) 的△H=
| A.2△H1+2△H2—2△H3 | B.△H1+△H2—△H3 |
| C.3△H1+2△H2+2△H3 | D.3△H1+2△H2—2△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH=?的化学反应,下列叙述不正确的是
| A.反应过程中能量关系如上图表示,则该反应为放热反应 |
| B.若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L |
| C.化学反应的焓变与反应方程式的计量系数有关 |
| D.若将该反应设计成原电池,锌为负极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com