
| A. | 盐酸滴入Na[Al(OH)4]溶液中 | B. | CO2气体通入漂白粉溶液中 | ||
| C. | NaOH溶液滴入AlCl3溶液中 | D. | Ba(OH)2溶液滴入Al2(SO4)3溶液中 |
分析 A、偏铝酸钠溶液中滴入盐酸,先生成氢氧化铝沉淀,继续滴加氢氧化铝溶解;
B、沉淀先随气体体积增大而增加,漂白粉全部消耗完后,沉淀先随气体体积增大而减小,直到完全没有沉淀;
C、将NaOH溶液逐滴滴入AlCl3溶液中,直至过量,先生成白色沉淀后沉淀消失;
D、氢氧化钡溶液滴入硫酸铝溶液中过程中一定有硫酸钡沉淀生成;
解答 解:A、偏铝酸钠溶液中滴入盐酸,先生成氢氧化铝沉淀,继续滴加氢氧化铝溶解,反应的离子方程式为AlO2-+H++H2O=Al(OH)3↓;Al(OH)3+3H+=Al3++3H2O,故A不选;
B、沉淀先随气体体积增大而增加,漂白粉全部消耗完后,沉淀先随气体体积增大而减小,直到完全没有沉淀,不符合题意,故B不选;
C、将NaOH溶液逐滴滴入AlCl3溶液中,直至过量,先生成白色沉淀后沉淀消失,故C不选;
D、氢氧化钡溶液滴入硫酸铝溶液中过程中一定有硫酸钡沉淀生成,会出现沉淀减少但不会出现沉淀全部溶解消失的现象,故D符合;
故选D.
点评 本题考查离子反应发生的条件,难度不大,掌握相关物质间的变化规律是解题的关键.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | CS2是非极性分子 | B. | CS2的沸点高于CO2 | ||
| C. | CS2不能在空气中燃烧 | D. | CS2能证明非金属性S>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
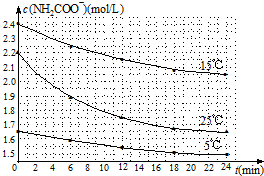
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2溶于水:3NO2+H2O=2H++2NO3-+NO | |
| B. | 用惰性电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+4H++O2↑ | |
| C. | NaClO溶液中通入过量的SO2:ClO-+SO2+H2O=HClO+HSO3- | |
| D. | NaAlO2溶液中通入过量的CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH3 | B. | C6H5-CH=CH2 | C. | C6H5-CH3 | D. | CH2=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在密闭容器中加入l.5mol H2和0.5molN2,充分反应后可得到NH3分子数为NA | |
| B. | 一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA | |
| C. | 7.1gCl2与足量的氢氧化钠溶液反应转移的电子数为0.2NA | |
| D. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ag+、CO32-、Cl- | B. | K+、Ba2+、SO42-、Cl- | ||
| C. | Na+、K+、CO32-、Cl- | D. | Na+、K+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 品红溶液褪色 | B. | 紫色石蕊溶液先变红后褪色 | ||
| C. | 酸性KMnO4溶液紫色褪去 | D. | 含酚酞的NaOH溶液红色变浅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com