
| A. | 从溴水中提纯单质溴的方法是:先用CCl4萃取,分液后再蒸馏 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 用盛NaOH溶液的洗气瓶除去CO2中混有的HCl气体 | |
| D. | 在实验室里,用澄清的石灰水和氯化铵溶液混合制取氨气 |
分析 A.溴易溶于有机溶剂,可以用有机溶剂萃取;
B.加入适量新制氯水,可氧化亚铁离子,再加入几滴KSCN溶液,溶液变红;
C.CO2与NaOH溶液反应;
D.氨气以及溶于水.
解答 解:A.溴易溶于有机溶剂,可以用有机溶剂萃取,溴易挥发,沸点低,可以用蒸馏的方法使CCl4和溴单质分离,故A正确;
B.添加试剂的顺序有误,应该先加入KSCN溶液,排除溶液中已经有Fe3+的可能性,若不变色说明原溶液中没有Fe3+,再加入氯水,进行检验,故B错误;
C.CO2与NaOH溶液反应,将原物质除掉,故C错误;
D.实验室制取氨气用的是熟石灰与氯化铵固体混合物加热的方法,故D错误.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质制备及分离与提纯、检验等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | K+、AlO2-、Cl-、SO42- | B. | H+、Ba2+、Cl-、NO3- | ||
| C. | Ca2+、Fe2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、HSO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
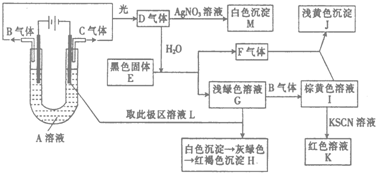
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学反应时必然伴随着能量变化 | |
| B. | 金属铜导电,故金属铜是电解质 | |
| C. | 自发反应都是熵增大的反应 | |
| D. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的还原剂是NH4+ | |
| B. | 消耗1mol氧化剂,转移2mol电子 | |
| C. | 氧化剂与还原剂的物质的量之比是2:3 | |
| D. | 反应后溶液酸性明显增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜与硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| B. | 铁在氯气中燃烧:2Fe+3Cl2═2Fe3++6Cl- | |
| C. | 硫酸铜溶液中滴加氢氧化钡溶液:SO42-+Ba2+═BaSO4↓ | |
| D. | 氧化铝与稀盐酸混合:Al2O3+6H+═2Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01 mol/L | B. | 0.02 mol/L | C. | 0.05 mol/L | D. | 0.06 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层电子数:Z>R>Y | |
| B. | 气态氢化物的稳定性:Y<Z | |
| C. | R、X的氧化物均为离子化合物 | |
| D. | X和Y两者最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com