
下列各组微粒的空间构型相同的是
①NH3和H2O
②NH4+和H3O+
③NH3和H3O+
④O3和SO2
⑤CO2和BeCl2
⑥NH4+和SO42-
⑦BF3和Al2Cl6
A.全部 B.③④⑤⑥ C.除⑦外 D.②③④⑤⑥
科目:高中化学 来源:2015-2016学年浙江省高一下期末化学试卷(解析版) 题型:选择题
如图为某种甲醇燃料电池示意图,工作时电子流向如图所示。下列判断正确的是
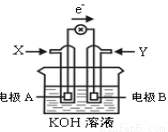
A.X为氧气
B.电极A反应式:CH3OH-6e-+H2O = CO2+6H+
C.B电极附近溶液pH增大
D.电池工作时,溶液中电子由电极B流向电极A
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都外国语学校高一下期末文科化学卷(解析版) 题型:选择题
在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%,下列反应类型能体现“绿色化学工艺”的是(  )。
)。
A . 化合反应 B.复分解反应 C.分解反应 D. 取代反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年新疆乌鲁木齐七十中高二下期末化学试卷(解析版) 题型:选择题
下列说法正确的是
A.乙醇中的-OH上的氢比水分子的一个-OH上的氢活泼
B.[TiCl(H2O)5]Cl2·H2O的配合物内界和外界Cl-的数目比是1:2
C.酸性:H3PO4<H3PO3
D.手性分子CH2=CH(CH2OH)COOH与足量的H2反应后分子有两个手性碳原子
查看答案和解析>>
科目:高中化学 来源:2015-2016学年新疆乌鲁木齐七十中高二下期末化学试卷(解析版) 题型:选择题
下列叙述中正确的是
A.CS2为V形的极性分子
B.Cl03- 的空间构型为平面三角形
C.SF6中有6对完全相同的成键电子对
D.SiF4和SO32- 的中心原子均为sp3杂化,空间构型为正四面体结构
查看答案和解析>>
科目:高中化学 来源:2015-2016学年新疆乌鲁木齐七十中高二下期末化学试卷(解析版) 题型:选择题
下列关于晶体的说法中,不正确的是
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性
②含有金属阳离子的晶体一定是离子晶体
③共价键可决定分子晶体的熔、沸点
④在分子晶体中一定不存在离子键,而在离子晶体中可能存在共价键
⑤晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列
⑥晶体尽可能采取紧密堆积方式,以使其变得比较稳定
⑦干冰晶体中,一个CO2分子周围有12个CO2分子紧邻
A.①②③ B.②③ C.④⑤⑥ D.②③④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西大学附中高二5月模块诊断化学试卷(解析版) 题型:填空题
如下所示是一种新型的烷基化反应

(1)化合物I的分子式为_________,1mol该物质完全燃烧最少需要消耗____molO2。
(2)化合物I可由CH3COOCH2CH3合成。化合物A是CH3COOCH2CH3的一种无支链同分异构体,碳链两端呈对称结构,且在Cu催化下与过量O2反应生成能发生银镜反应的化合物B。A的结构简式为______ ______,B的结构简式为____________。
______,B的结构简式为____________。
(3)化合物C(分子式为C10H11Cl)可与NaOH水溶液共热生成化合物II,相应的化学方程式为________________________________________________。
(4)化合物C与NaOH乙醇溶液共热生成化合物D,D的核磁共振氢谱除苯环峰外还有四组峰,峰面积之比为1∶1∶1∶2,D的结构简式为________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高一下期末化学试卷(解析版) 题型:实验题
实验室制备硝基苯的反应原理和实验装置如下:
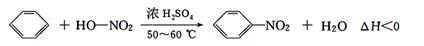
存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯,有关数据如表:
物质 | 熔点/℃ | 沸点/℃ | 密度/ g·cm-3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 |
| 83 | 1.4 | 易溶于水 |
浓硫酸 |
| 338 | 1.84 | 易溶于水 |
实验步骤如下:
取100 mL烧杯,用20 mL浓硫酸与18 mL浓硝酸配制混合液,将混合酸小心加入B中,把17.73 mL(15.6 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀,在50~60 ℃下发生反应,直至反应结束。
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5% NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~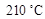 馏分,得到纯硝酸基苯18.45 g。回答下列问题:
馏分,得到纯硝酸基苯18.45 g。回答下列问题:
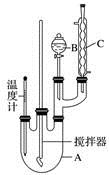
(1)装置B的名称是________,装置C的作用是____________________;
(2)配制混合液时,________(填“能”或“不能”)将浓硝酸加入到浓硫酸中,说明理由:________________________________________________________________________;
(3)为了使反应在50~60 ℃下进行,常用的方法是____________;
(4)在洗涤操作中,第二次水洗的作用是______________________________________;
(5)本实验所得到的硝基苯产率是_________________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二下期末化学试卷(解析版) 题型:填空题
铜及其化合物在工业上有许多用途。回答下列问题:
(1)某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:

①浸取反应中氧化剂的化学式为_______;滤渣Ⅰ的成分为MnO2、S和_________(写化学式)。
②“除铁”这一步反应在25℃进行,加入试剂A调节溶液PH为4后,溶液中铜离子最大浓度不超过__________mol/L。(已知Ksp[Cu(OH)2]=2.2×10-20)
③“沉锰”(除Mn2+)过程中反应的离子方程式__________________________ 。
④ 滤液Ⅱ经蒸发结晶得到的盐主要是____________________ (写化学式)。
(2)某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动。
①如下左图为某实验小组设计的原电池装置,盐桥内装载的是足量用饱和氯化钾溶液浸泡的琼脂,反应前,电极质量相等,一段时间后,两电极质量相差6.00 g,则导线中通过了________mol电子,若不考虑甲、乙两池电解质溶液中的离子向盐桥中移动,则甲、乙两池电解质溶液的总质量与实验开始前的电解质溶液的总 质量相差__________g
质量相差__________g

②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如上右图所示,电流计指针偏转方向与先前一样,但偏转角度明显减小。一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH________(填“减小”、“增大”或“不变”) ,乙池中石墨为________极(填“正”、“负”、“阴”或“阳”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com