
下列关于离子共存或离子反应的说法正确的是
A.某无色溶液中可能大量存在H+、Cl-、MnO4-
B.pH=2的溶液中可能大量存在Na+、NH4+、SiO32-
C.Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
D.稀硫酸和氢氧化钡溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源:2015-2016学年安徽六安一中高一下周末作业四化学试卷(解析版) 题型:填空题
化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活。
【I】日常生活中使用的各种电池就是利用化学反应将化学能转化为电能,各种各样的电池的发展是化学对人类的一项重大贡献。请回答下列有关化学电源的问题:
(1)下列有关电池的叙述中正确的是___________。
A.锌锰干电池工作一段时间后碳棒变细 B.氢氧燃料电池可将热能直接转变为电能
C.甲烷燃料电池工作时甲烷在负极被氧化 D.太阳能电池的主要材料是高纯度的二氧化硅
(2)锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述正确的是( )
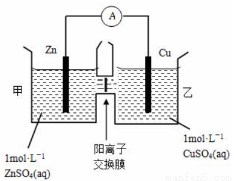
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO42-)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.甲池中的阳离子向乙池移动,保持溶液中电荷平衡
【II】自来水厂生产自来水时,需要用到净水剂,对水进行消毒杀菌处理。
(3)高铁酸钾(K2FeO4)是一种新型多功能水处理剂。工业上有多种方法制备高铁酸钾,其中一种方法是在氢氧化钾溶液中用次氯酸钠氧化氢氧化铁。该反应的可用离子方程式表示为___________。
(4)用高铁酸钾和锌制成的高铁碱性电池,能储存比普通碱性电池多50%的电能,己知该电池的总反应为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,则负极的电极反应是______________。
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(江苏卷参考版) 题型:选择题
化合物X是一种医药中间体,其结构简式如图所示。下列有关化合物X的说法正确的是
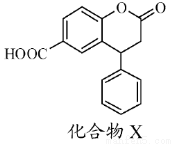
A.分子中两个苯环一定处于同一平面
B.不能与饱和Na2CO3溶液反应
C.在酸性条件下水解,水解产物只有一种
D.1 mol化合物X最多能与2 molNaOH反应
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(天津卷参考版) 题型:选择题
下列实验的反应原理用离子方程式表示正确的是( )
A.室温下,测的氯化铵溶液pH<7,证明一水合氨的是弱碱:NH4++2H2O=NH3·H2O+H3O+
B.用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O=2AlO2-+3H2↑
C.用碳酸氢钠溶液检验水杨酸中的羧基:
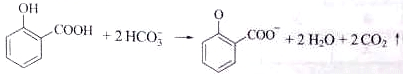
D.用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(四川卷参考版) 题型:填空题
M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)R基态原子的电子排布式是① ,X和Y中电负性较大的是 ② (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是___________。
(3)X与M形成的XM3分子的空间构型是__________。
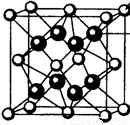
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如右图所示,则图中黑球代表的离子是_________(填离子符号)。
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是____________。
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(全国3卷参考版) 题型:简答题
[化学——选修2:化学与技术]
聚合硫酸铁(PFS)是谁处理中重要的絮凝剂,下图是以回收废铁屑为原料制备PFS的一种工艺流程。

回答下列问题
(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为_________。粉碎过筛的目的是_______
(2)酸浸时最合适的酸是_____,写出铁锈与酸反应的离子方程式_____________________。
(3)反应釜中加入氧化剂的作用是_________,下列氧化剂中最合适的是____________(填标号)。
A.KMnO4 B. C.
C.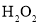 D.
D.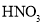
(4)聚合釜中溶液的pH必须控制在一定的范围内,pH偏小时Fe3+水解程度弱,pH偏大时则_______。
(5)相对于常压蒸发,减压蒸发的优点是______。
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,定义式为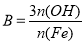 (n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c
(n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c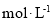 的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液V mL。按照上述步骤做空白对照试验,消耗NaOH溶液
的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液V mL。按照上述步骤做空白对照试验,消耗NaOH溶液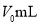 ,已知该样品中Fe的质量分数w,则B的表达式为__________
,已知该样品中Fe的质量分数w,则B的表达式为__________
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(全国3卷参考版) 题型:选择题
已知异丙苯的结构简式如下,下列说法错误的是
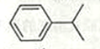
A.异丙苯的分子式为C9H12
B.异丙苯的沸点比苯高
C.异丙苯中碳原子可能都处于同一平面
D.异丙苯的和苯为同系物
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(全国1卷参考版) 题型:推断题
[化学——选修5:有机化学基础]
秸秆(含多糖物质)的综合应用具有重要的意义。下面是以秸秆为原料合成聚酯类高分子化合物的路线:
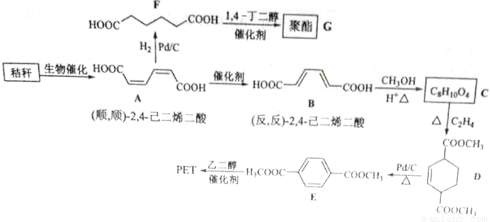
回答下列问题:
(1)下列关于糖类的说法正确的是______________。(填标号)
a.糖类都有甜味,具有CnH2mOm的通式
b.麦芽糖水解生成互为同分异构体的葡萄糖和果糖
c.用银镜反应不能判断淀粉水解是否完全
d.淀粉和纤维素都属于多糖类天然高分子化合物
(2)B生成C的反应类型为______。
(3)D中官能团名称为______,D生成E的反应类型为______。
(4)F 的化学名称是______,由F生成G的化学方程式为______。
(5)具有一种官能团的二取代芳香化合物W是E的同分异构体,0.5 mol W与足量碳酸氢钠溶液反应生成44 gCO2,W共有______种(不含立体结构),其中核磁共振氢谱为三组峰的结构简式为_________。
(6)参照上述合成路线,以(反,反)-2,4-己二烯和C2H4为原料(无机试剂任选),设计制备对二苯二甲酸的合成路线_______________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二下期中化学试卷(解析版) 题型:选择题
组成和结构可用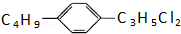 表示的有机物共有(不考虑立体结构)( )
表示的有机物共有(不考虑立体结构)( )
A.24种 B.28种 C.32种 D.36种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com