
(1)北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体。火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料。试回答下列问题:
①右图是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,请在附图中的括号内填入“+”或“—”。
②写出表示丙烷燃烧热的热化学方程式:
___________________________________。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为_______。
(2)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知: H2O(g)=H2O(l) △H1=-Q1kJ/mol
C2H5OH(g)=C2H5OH(l) △H2=-Q2kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3kJ/mol
若使23g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为____________kJ。
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体。火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料。试回答下列问题:
①右图是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,请在附图中的括号内填入“+”或“—”。

②写出表示丙烷燃烧热的热化学方程式:
___________________________________。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为_______。
(2)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知: H2O(g)=H2O (l) △H1=-Q1 kJ/mol
C2H5OH(g)=C2H5OH (l) △H2=-Q2 kJ/mol
C2H5OH (g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3 kJ/mol
若使23g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为____________kJ。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省南京三中高二下学期期中考试化学试卷(带解析) 题型:填空题
(1)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。丙烷脱氢可得丙烯。
已知:C3H8(g) ="==" CH4(g)+HC≡CH(g)+H2(g) △H1="+156.6" kJ·mol-1
CH3CH=CH2(g)="==" CH4(g)+ HC≡CH(g ) △H2="+32.4" kJ·mol-1
则C3H8(g) ="==" CH3CH=CH2(g)+H2(g) △H = kJ·mol-
(2)发射火箭时用肼(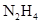 )作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知
)作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知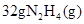 完全发生上述反应放出
完全发生上述反应放出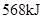 的热量,热化学方程式是:
的热量,热化学方程式是:
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com