
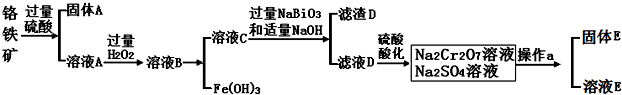

分析 铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质),加入过量稀硫酸,固体A为SiO2,溶液A中含有Cr3+、Al3+、Fe2+,在A中加入过氧化氢,可生成Fe3+,调节溶液pH可除去Fe3+、Al3+,生成氢氧化铁、氢氧化铝沉淀,即固体D,溶液C含有Cr3+,在溶液C中加入NaBiO3和NaOH,发生氧化还原反应,固体D为Bi(OH)3,溶液D含有Na2CrO4,酸化可得Na2Cr2O7,溶液经蒸发浓缩、冷却结晶可得Na2Cr2O7•2H2O,以此解答该题.
(1)三氧化二铬与铝在高温条件下发生置换反应生成铬与三氧化二铝;
(2)盐酸中的氯是-1价具有还原性,会CrO42-被氧化成氯气;
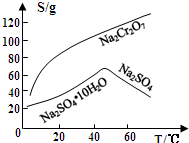
(3)由图2可知Na2Cr2O7的溶解度随温度的升高而增大,而硫酸钠的温度随温度的升高而降低,所以采用蒸发结晶、趁热过滤的方法分离硫酸钠;
(4)①Cr(OH)3的化学性质与Al(OH)3相似,如果氢氧化钠过量Cr(OH)3会溶解;
②可以代替上述流程中Na2S2O3溶液,需要具有还原性,能还原重铬酸根离子;
③根据Ksp[Cr(OH)3]=c(Cr3+)•(OH-)3,来计算铬离子的浓度是否小于10-5mol/L;
④每消耗0.1mol Na2S2O3转移0.8mol e-,Na2S2O3 ~2SO42-~8e-,Cr2O72-~2Cr3+~6e-,依据氧化还原反应电子守恒分析配平书写氧化还原反应的离子方程式.
解答 解:(1)三氧化二铬与铝发生铝热反应的方程式为:Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Cr+Al2O3,
故答案为:Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Cr+Al2O3;
(2)盐酸中的氯是-1价具有还原性,会CrO42-被氧化成氯气,
故答案为:盐酸中的Cl-会被氧化,产生Cl2;
(3)由图2可知Na2Cr2O7的溶解度随温度的升高而增大,而硫酸钠的温度随温度的升高而降低,所以采用蒸发结晶、趁热过滤的方法分离硫酸钠,
故答案为:蒸发结晶、趁热过滤;
(4)①Cr(OH)3的化学性质与Al(OH)3相似,如果氢氧化钠过量Cr(OH)3会溶解,
故答案为:pH过高Cr(OH)3会与过量的NaOH 反应;
②可以代替上述流程中Na2S2O3溶液,需要具有还原性,能还原重铬酸根离子;
A.FeSO4溶液中亚铁离子具有还原性,可以还原Cr2O72-离子,但又引入新的杂质离子铁离子,故A不符合;
B.浓H2SO4 具有强氧化性,不能表现还原性,不能还原Cr2O72-,故B不符合;
C.酸性KMnO4 是强氧化剂不能还原Cr2O72-,故C不符合;
D.Na2SO3溶液中亚硫酸根离子具有还原性,可以还原Cr2O72-,故D符合;
故答案为:D;
③pH=5时,(OH-)=10-9mol/L,所以c(Cr3+)•(10-9)3=6.3×10-31,解之得c(Cr3+)=6.3×10-4>10-5,所以没有沉淀完全,
故答案为:c(Cr3+)•(10-9)3=6.3×10-31,解之得c(Cr3+)=6.3×10-4>10-5,所以没有沉淀完全;
④每消耗0.1mol Na2S2O3转移0.8mol e-,Na2S2O3 ~2SO42-~8e-,Cr2O72-~2Cr3+~6e-,依据氧化还原反应电子守恒配平书写,3Na2S2O3 ~6SO42-~24e-,4Cr2O72-~8Cr3+~24e-,得到的氧化还原反应的离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
点评 本题考查了物质分离提纯的方法和过程分析,离子方程式书写,溶度积常数的计算应用,主要是氧化还原反应的理解应用,掌握基础是关键,题目难度中等.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化亚铁溶液中加入氢氧化钠溶液,先有白出现,后白色沉淀逐渐消失 | |
| B. | 将铜片放人氯化铁溶液,钢片表面生成银白色的铁 | |
| C. | 在氯化铁溶液中滴入氢氧化钠溶液,有红褐色沉淀出现 | |
| D. | 将铜粉加人冷的浓硝酸中会发生钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有6.02×1023个氦原子的氦气在标准状况下的体积约为11.2 L | |
| B. | 在常温常压下,11.2 L Cl2含有的分子数为0.5×6.02×1023 | |
| C. | 25℃,1.01×105Pa,64 g SO2中含有的原子数为3×6.02×1023 | |
| D. | 标准状况下,11.2 L H2O含有的分子数为0.5×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动了 | B. | 物质A的转化率增加了 | ||
| C. | 物质B的质量分数减少了 | D. | b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫一碘循环分解水制氢主要涉及下列反应:
硫一碘循环分解水制氢主要涉及下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过NaOH溶液后再通过浓硫酸 | B. | 通过CuSO4溶液后再通过石灰水 | ||
| C. | 通过P2O5后再通过固体NaOH | D. | 通过碱石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +2 | B. | +4 | C. | 0 | D. | +6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com