
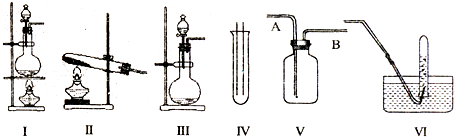
分析 (1)若用CaCO3与盐酸反应制CO2,为固体和液体的反应,常温下可进行;用I装置制取氯气,浓盐酸放在分液漏斗中,浓盐酸和二氧化锰在加热条件下反应生成氯气、氯化锰和水;
(2)氯气密度比空气大,用向上排空法收集,可用湿润的淀粉碘化钾验满;
(3)氯气与氢氧化钠溶液反应,可用于吸收尾气;
(4)设水的体积为1L,HCl的体积为336L,根据n=$\frac{V}{{V}_{m}}$计算气体的物质的量,进而计算气体的质量,根据溶液总质量计算所得盐酸溶液中溶质的质量分数,根据c=$\frac{1000ρω}{M}$计算溶液的物质的量浓度.
解答 解:(1)若用CaCO3与盐酸反应制CO2,为固体和液体的反应,常温下可进行,可选择Ⅲ装置,用I装置制取氯气,浓盐酸放在分液漏斗中,浓盐酸和二氧化锰在加热条件下反应生成氯气、氯化锰和水,反应的方程式为:MnO2+4HC1(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnC12+C12↑+2H2O,
故答案为:Ⅲ;分液漏斗;MnO2+4HC1(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnC12+C12↑+2H2O;
(2)氯气的密度大于空气的密度,所以应采用向上排空气法收集氯气,故A为进气口;氯气的氧化性大于碘的氧化性,所以氯气能置换出碘化钾中的碘,且碘遇淀粉变蓝色,所以可用湿润的淀粉KI试纸检验是否收集满了氯气.
故答案为:A;将湿润的淀粉KI试纸放在B口处,试纸变蓝色,证明氯气已集满;
(3)氯气有毒,逸出会污染大气,所以不能让氯气逸出;氯气和水能反应是盐酸和次氯酸,盐酸和次氯酸是酸,都能和碱反应,所以可用氢氧化钠溶液吸收氯气,
故答案为:NaOH溶液;2NaOH+Cl2=NaCl+NaClO+H2O;
(4)1体积的水已吸收336体积的HCl,可设水的体积为1L,HCl的体积为336L,则标准状况下336L HCl的物质的量为:$\frac{336L}{22.4L/mol}$=15mol,质量为m=nM=36.5g/mol×15mol=547.5g,则所得盐酸溶液中溶质的质量分数为w=$\frac{547.5g}{1000g+547.5g}$×100%≈35.4%,
溶质的物质的量浓度为:c=$\frac{1000×1.08×35.4%}{36.5}$mol/L≈10.5mol/L,
故答案为:10.5.
点评 本题考查了实验装置的应用、物质的量浓度的计算,侧重于氯气的实验室制法、气体的检验等知识的考查,题目难度中等,注意根据反应物的状态及反应条件选择相应的装置,明确物质的量浓度与溶质质量分数的关系,试题培养了学生的化学实验、化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 醋酸是中学常用的一种弱酸.
醋酸是中学常用的一种弱酸.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向水中加入少量硫酸氢钠固体 | B. | 向水中加入少量硫酸铝固体 | ||
| C. | 向水中加入少量氯化铵固体 | D. | 将水加热到100℃,使水的pH=6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| B. | 向AlCl3溶液中滴加过量的氨水能看到先产生白色沉淀,后沉淀溶解 | |
| C. | 可用浓硫酸或者浓硝酸除去镀在铝表面的铜镀层 | |
| D. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉就会溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com