
常见的纽扣电池为Ag Zn电池,它用不锈钢制成一个由正极壳和负极盖组成的小圆盒,盒内靠正极壳一端填充Ag2O和少量石墨组成的正极活性材料,负极盖一端填充Zn
Zn电池,它用不锈钢制成一个由正极壳和负极盖组成的小圆盒,盒内靠正极壳一端填充Ag2O和少量石墨组成的正极活性材料,负极盖一端填充Zn Hg合金作负极的活性材料,电解质溶液为浓KOH溶液。写出此电池的正极和负极反应式以及电池总反应式。
Hg合金作负极的活性材料,电解质溶液为浓KOH溶液。写出此电池的正极和负极反应式以及电池总反应式。
科目:高中化学 来源: 题型:填空题
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。在X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式是 。
②Y电极的材料是 ,电极反应式是 。
(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油。
已知:①CH4 (g) + H2O (g)= CO (g)+3H2 (g) △H1=+206.2kJ·mol-1
② CH4(g)+ O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③CH4 (g) + 2H2O (g) =CO2 (g) +4H2 (g) △H3="+165.0" kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为 。
(2)从原料选择和能源利用角度,比较方法①和②,为合成甲醇,用甲烷制合成气的适宜方法为 (填序号),其原因是 。
(3)合成气中的H2可用于生产NH3,在进入合成塔前常用Cu(NH3)2Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
Cu(NH3)2Ac + CO + NH3 [Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)3]Ac·CO △H<0
Cu(NH3)2Ac溶液吸收CO的适宜生产条件应是 。
(4)将CH4设计成燃料电池,其利用率更高,装置示意如右图(A、B为多孔性碳棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。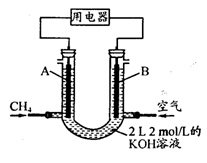
① 0<V≤44.8 L时,电池总反应方程式为 ;
② 44.8 L<V≤89.6 L时,负极电极反应为 ;
③ V="67.2" L时,溶液中离子浓度大小关系为 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(15分)氯化亚铜(CuCl)是一种白色固体,微溶于水,不溶于酒精。研究该物质的应用新领域、生产新方法及生产过程中的环保新措施都具有重要意义。
(1)镁—氯化亚铜海水电池,可用于鱼雷上。该电池被海水激活时,正极导电能力增强,同时产生气泡,则正极上被还原的物质有 、 (填化学式)。
(2)工业上以铜作催化剂,氯代甲烷和硅粉反应合成甲基氯硅烷的过程中产生大量废渣(主要成分为硅粉、铜、碳等)。某课外小组以该废渣为原料制CuCl,流程示意图如下: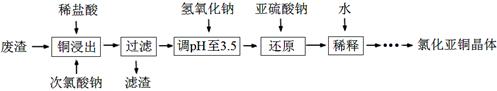
回答下列问题:
①氯代甲烷有4种,其中属于重要工业溶剂的是 (写出化学式)。
②“还原”阶段,SO32-将Cu2+还原得[CuCl2]-,完成下列离子方程式。 Cu2++
Cu2++ Cl-+
Cl-+ SO32-+
SO32-+ =
= [CuCl2]-+
[CuCl2]-+ +
+
③在稀释过程中存在下列两个平衡:
ⅰ [CuCl2]- CuCl+Cl- K=2.32
CuCl+Cl- K=2.32
ⅱ CuCl(s) Cu+(aq)+Cl- Ksp=1.2×10-6
Cu+(aq)+Cl- Ksp=1.2×10-6
当[CuCl2]-完成转化时(c([CuCl2]-)≤1.0×10-5 mol·L-1),溶液中c(Cu+)≥ 。
④获得CuCl晶体需经过滤、洗涤、干燥。洗涤时,常用无水乙醇代替蒸馏水做洗涤剂的优点是 (写一点)。
(3)工业生产CuCl过程中产生浓度为2~3 g·L-1的含铜废水,对人及环境都有较大的危害,必须进行回收利用。用萃取法富集废水中的铜,过程如下:
①实验室完成步骤ⅰ时,依次在分液漏斗中加入曝气后的废水和有机萃取剂,经振荡并 后,置于铁架台的铁圈上静置片刻,分层。分离上下层液体时,应先 ,然后打开活塞放出下层液体,上层液体从上口倒出。
②写出步骤ⅱ的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(10分)某化学兴趣小组的同学为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
向8 g某二价金属的氧化物固体中加入稀硫酸,使其恰好完全溶解,已知消耗硫酸的体积为100 mL,在所得溶液中插入铂电极进行电解,通电一定时间后,在一个电极上收集到224 mL(标准状况)氧气,在另一个电极上析出该金属1.28 g。
(1)根据计算确定金属氧化物的名称。
(2)求通电后硫酸溶液的物质的量浓度(溶液体积按100 mL计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(18分)废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法回收WC和制备CoxOy,的工艺流程简图如下:
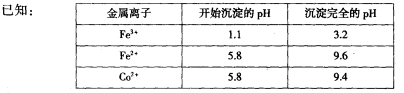
(1)电解时废旧刀具作阳极,不锈钢作阴极,盐酸的作用是______。
(2)通人氨气的目的是调节溶液的pH,除去铁元素。由表中的数据可知,理论上可选择pH最大范围是____________。
(3)实验测得NH4HCO3溶液显碱性,制备CoCO3时,选用的加料方式是_______(填代号),原因是_______。
a.将滤液与NH4HCO3溶液同时加入到反应容器中
b.将滤液缓慢加入到盛有NH4HCO3溶液的反应容器中
c.将NH4HCO3溶液缓慢加入到盛有滤液的反应容器中
写出生成CoCO3的离子方程式______________________________________。
(4)实验中获得的若洗涤不充分,在焙烧时会产生污染性气体,该污染性气体的成分为_______________(填化学式)。
(5)实验室用下列装置制取 ,并测定其化学式。
,并测定其化学式。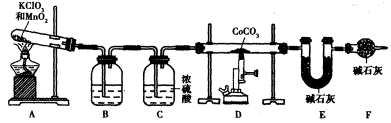
①装置A制得的中含有少量Cl2,则装置B中所盛放的试剂为______(填代号)。
a.NaHCO3溶液 b.NaOH溶液 c.KMnO4溶液 d.饱和NaCI溶液
②在CoCO3完全转化为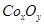 后,若称得E管增重4.40g,D管内残留物质的质量是8.30g,则生成物
后,若称得E管增重4.40g,D管内残留物质的质量是8.30g,则生成物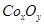 的化学式为____________。
的化学式为____________。
③若缺少装置F,则导致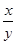 的值______(填“偏大”、“偏小”或“无影响”)。
的值______(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是
①可能有C2H2
②一定有CH4
③一定有C3H8
④一定没有C2H6
⑤可能有C2H6
| A.②⑤ | B.②④ | C.③④ | D.②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列除去括号内杂质的有关操作方法不正确的是 ( )
| A.乙烷(乙炔):通过盛溴水的洗气瓶 |
| B.乙酸乙酯(乙醇):加入乙酸和浓硫酸的混合液,然后加热 |
| C.苯(苯酚):加入氢氧化钠溶液,然后分液 |
| D.乙醇(水):加入生石灰,然后蒸馏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com