
某同学通过系列实验探究Mg及其化合物的性质,操作正确且能达到目的的是
A.将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成
B.将水加入浓硫酸中得到稀硫酸,置镁片于其中探究讨Mg的活泼性
C.将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀
D.将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源:2014-2015学年浙江省丽水市高三第一次模拟理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.在人类研究物质微观结构的过程中,先后使用了光学显微镜、电子显微镜、扫描隧道显微镜三种不同层次的观测仪器
B.铝硅酸盐分子筛可用于物质分离,还可用作干燥剂、催化剂及催化剂载体
C.使用可再生资源、提高原子经济性、推广利用二氧化碳与环氧丙烷生成的可降解高聚物等都是绿色化学的内容
D.铁盐会水解产生具有吸附性的胶体粒子,可用于饮用水的杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是配制一定物质的量浓度溶液的过程示意图。下列说法中错误的是

A.所配制的Na2CO3溶液的物质的量浓度为1 mol/L
B.操作2是将溶解的Na2CO3溶液转移到容量瓶中
C.操作4是滴加水至溶液凹液面的最低点与刻度线平齐
D.操作5中,摇匀后发现液面低于刻度线,则要继续加水至液面与刻度线平齐
查看答案和解析>>
科目:高中化学 来源: 题型:
在中学化学实验中使用的玻璃、陶瓷等仪器,在实验操作中不能承受温度的急剧变化,否则会引起安全事故。下列实验操作过程不是基于上述原因的是( )
A、用排水法收集气体后,先移出导气管,后熄灭酒精灯
B、在用二氧化锰和浓盐酸制氯气时,在加入二氧化锰后应首先加入浓盐酸,然后再点燃酒精灯
C、在用固体氯化铵和氢氧化钙制取氨气结束后,将大试管从铁架台上取下置于石棉网上冷却后再洗涤
D、钠与水反应时,只能取黄豆粒大小的钠投入盛水的烧杯中反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验的现象与对应结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 燃着的镁条伸入盛CO2的集气瓶中 | 镁条继续燃烧 | 镁有比较强的还原性 |
| B | 用容量瓶配制溶液时,定容后摇匀 | 液面低于刻度线 | 浓度一定偏高 |
| C | 向某溶液中加入酸化的硝酸钡溶液 | 有白色沉淀生成 | 原溶液中含有SO42- |
| D | 将刚切开的钠块露置在空气中 | 表面变暗 | 钠表面生成Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列依据相关实验得出的结论正确的是
A.在0.1mol·L-1 Na2CO3溶液中,加两滴酚酞显浅红色,微热后红色加深,说明盐类水解反应是吸热反应
B.用铂丝蘸取少量某溶液进行焰色反应,透过蓝色钴玻璃观察到火焰呈紫色,该溶液一定是钾盐溶液
C.向某FeCl2溶液中加入KSCN溶液,观察到溶液呈血红色,说明该溶液中FeCl2已全部被氧化
D.向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定含有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验原理或实验操作正确的是
A. 用pH试纸测量新制氯水的pH
B. 实验室用如图所示装置制饱和氯水
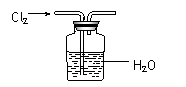

C.利用丁达尔效应鉴别淀粉胶体和NaCl溶液
D.用量筒量取20 mL 0.5000 mol·L-1H2SO4溶液于烧杯中,加水80 mL,配制成0.1000 mol·L-1H2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、R 、W是5种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族, Z、R 、W同周期。下列说法错误的是( )
A.气态氢化物稳定性:HmW>HnR
B.标准状况下,1mol XW4的体积约为22.4L
C.Y和Z形成的某种化合物中含离子键、非极性健 w ww.k s5u. co m
D.Y、Z、R三者形成的某种化合物溶于水后,可形成碱性溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度时,在0.5 L密闭容器中某一反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析求得:
(1)该反应的化学方程式为___________________________。
(2)反应开始至4 min时,B的平均反应速率为________。
(3) 平衡时A的转化率为_________。第4min时,正、逆反应速率的大小关系为:v(正)______v(逆)(填“>”、“<”或“=”,下同),第8min时,v(正)________v(逆).

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com