
| A. |  | B. |  | C. |  | D. |  |
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案科目:高中化学 来源: 题型:选择题
| A. | 家庭不宜用铝锅长期盛放菜,汤等食品 | |
| B. | 明矾[KAl(SO4)2•12H2O]含结晶水,是混合物 | |
| C. | Al既能与盐酸反应,又能与NaOH溶液反应 | |
| D. | 铝热反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+ | B. | Fe2+ | C. | Cu2+ | D. | 无减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中碳原子不在一条直线上 | B. | 光照不能够发生取代反应 | ||
| C. | 是石油分馏的一种产品 | D. | 比丁烷更易液化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | +4、-2 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.102 | 0.110 | 0.143 | 0.160 | 0.186 |
 ,其中所含的化学键类型为离子键和非极性键.
,其中所含的化学键类型为离子键和非极性键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
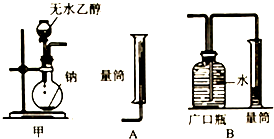
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com