
| A. | 三种溶液中,相关微粒存在如下关系:c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ) | |
| B. | 三种溶液中离子浓度c(X-)<c(Y-)<c(Z-) | |
| C. | 将三种溶液均加水稀释到1000mL后,三种溶液的pH分别为8、9、10 | |
| D. | HX、HY、HZ的酸性依次增强,电离平衡常数K(HX)>K(HY)>K(HZ) |
分析 常温下,0.1mol/L的三种盐溶液NaX.NaY.NaZ的PH分别为7、8、9,对于弱酸,其酸性越弱,对应的盐水解程度越大,说明HX为强酸,HY、XZ为弱酸,且酸性HY>XZ,由此分析解答.
解答 解:A、NaX电离后不水解,X-的物质的量浓度c(X-)=0.1mol/L,NaY、NaZ电离后都部分水解,根据物料守恒可知:c(Y-)+c(HY)=0.1mol/L;c(Z-)+c(HZ)=0.1mol/L,所以c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ),故A正确;
B、酸越弱水解的程度越大,离子浓度越小,所以c(X-)>c(Y-)>c(Z-),故B错误;
C、三种溶液均加水稀释到1000mL后,NaX的PH等于7,而对NaY、NaZ溶液的水解起促进作用,故C错误;
D、电离平衡常数对弱电解质HY、XZ,而HX完全电离,无电离平衡常数,故D错误;
故选:A.
点评 本题考查盐类的水解,题目难度不大,注意酸根离子水解程度越大,对应的酸越弱.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2LCH4中含有的氢原子数为2NA | |
| B. | 标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA | |
| C. | 2.7g铝与足量的盐酸反应,失去的电子数为0.3NA | |
| D. | 0.1mol/L MgCl2溶液中含Mg2+数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,44gCO2中含有的氧原子数目为2NA | |
| B. | 标准状况下,22.4LH2O含有的分子数目为NA | |
| C. | 1mol•L-1K2SO4溶液中含有的钾离子数目为2NA | |
| D. | 1molFe在足量的Cl2中完全燃烧,转移的电子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
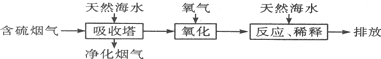
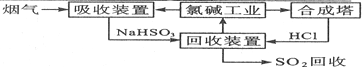
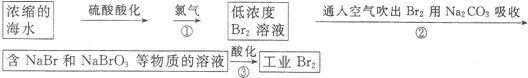
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用瓷坩埚灼烧氢氧化钠固体 | |
| B. | 中和热测定实验中可用铜制搅拌棒代替玻璃环形搅拌棒 | |
| C. | 用酸式滴定管量取12.00mL高锰酸钾溶液 | |
| D. | 用pH试纸测定溶液pH时先润湿,测得溶液的pH都偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


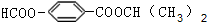 .
.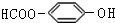 . (写结构简式)
. (写结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| W | Z |
| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 物质WY2、W3X4、WZ4均有熔点高、硬度大的特性 | |
| D. | X的阴离子比Y的阴离子离子半径大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
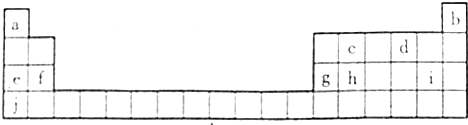
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,用0.1000mol•L-1的NaOH溶液滴定20mL 0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示,下列说法不正确的是( )
25℃时,用0.1000mol•L-1的NaOH溶液滴定20mL 0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示,下列说法不正确的是( )| A. | 可用酚酞作该滴定的指示剂 | |
| B. | 当溶液中c(H+)+c(OH-)=2×10-7时,c(Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 当滴定到pH=4.75时,c(A-)>c(Na+)>c(HA) | |
| D. | 当滴入40mL NaOH溶液时,溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com