
 已知反应:3I-(aq)+S2O82-(aq)═I3-(aq)+2SO42-(aq)+Q
已知反应:3I-(aq)+S2O82-(aq)═I3-(aq)+2SO42-(aq)+Q| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol•L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82-)/mol•L-1 | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
分析 (1)K为生成物浓度幂之积与反应物浓度幂之积;
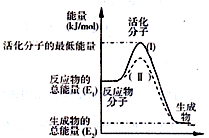
(2)由图可知,反应物总能量大于生成物总能量,为放热反应,使用催化剂不改变焓变,降低反应所需的活化能;
(3)由表格中的数据可知,只有浓度为变量,且反应速率与浓度的乘积成正比,以此来解答.
解答 解:(1)由3I-(aq)+S2O82-(aq)═I3-(aq)+2SO42-(aq)可知K=$\frac{{c}^{2}(S{{O}_{4}}^{2-})c({{I}_{3}}^{-})}{{c}^{3}({I}^{-})c({S}_{2}{{O}_{8}}^{2-})}$,故答案为:$\frac{{c}^{2}(S{{O}_{4}}^{2-})c({{I}_{3}}^{-})}{{c}^{3}({I}^{-})c({S}_{2}{{O}_{8}}^{2-})}$;
(2)由图可知,反应物总能量大于生成物总能量,为放热反应,则Q>0,使用催化剂不改变焓变,降低反应所需的活化能,则使用催化剂的是(II)曲线,
故答案为:>;(II);
(3)由表格中的数据可知,只有浓度为变量,该实验的目的为研究I-、S2O82-浓度对反应速率的影响;且反应速率与浓度的乘积成正比,可知③⑤中浓度乘积相同,则t1=22s,实验结论为反应速率与反应物浓度乘积成正比,
故答案为:研究I-、S2O82-浓度对反应速率的影响;22;反应速率与反应物浓度乘积成正比.
点评 本题考查平衡常数的意义、探究反应速率的影响因素、反应中能量变化,为高频考点,把握K的表达式、习题中图象及表格数据的分析为解答的关键,侧重分析与应用能力的考查,注意(3)为解答的难点,题目难度不大.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案科目:高中化学 来源: 题型:解答题
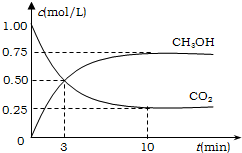 工业上有一种方法有效地开发利用CO2,是用CO2来生产燃料甲醇.为探究反应原理,进行如下实验,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
工业上有一种方法有效地开发利用CO2,是用CO2来生产燃料甲醇.为探究反应原理,进行如下实验,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学键 | C-H | C-C | C═C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | 612 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
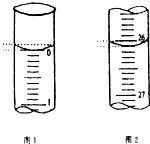 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熵变小于零而焓变大于零的反应肯定不能自发发生 | |
| B. | 热化学方程式中△H的值与反应物的用量有关 | |
| C. | 化学反应中旧键断裂吸收能量,新键形成释放能量,所以化学反应伴随能量变化,但反应前后物质的总能量不变 | |
| D. | 其他条件不变,增大反应物浓度是通过增大活化分子百分数,使化学反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同温度下,饱和溶液一定比不饱和溶液导电性强 | |
| B. | 氯化钠溶液在电流作用下电离成钠离子和氯离子 | |
| C. | 晶体NaCl不导电,所以它不是电解质,而铜、铁等金属能导电,所以它们是电解质 | |
| D. | 氯化氢溶于水能导电,但液态氯化氢不导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 装 置 | 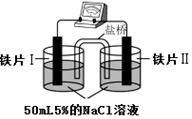 | 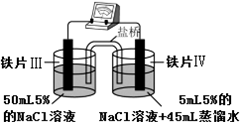 |
| 现象 | 电流计指针未发生偏转 | 电流计指针发生偏转 |
| A. | “电流计指针未发生偏转”,说明铁片Ⅰ、铁片Ⅱ均未被腐蚀 | |
| B. | 铁片Ⅳ的电极反应式可能为Fe-3e-=Fe3+ | |
| C. | 用K3Fe(CN)6]溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断装置的正、负极 | |
| D. | 铁片Ⅰ、Ⅲ所处的电解质溶液浓度相同,所以二者的腐蚀速率相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com