
【题目】下列说法不正确的是( )
A. Na2O2用作呼吸面具的供氧剂B. NaHCO3的热稳定性大于Na2CO3
C. 乙醇可与金属钠反应放出氢气D. 钠久置在空气中最终产物为Na2CO3
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:
【题目】【内蒙古鄂尔多斯市2017届高三模拟考试理综化学试题】现以CO、O2、熔熔盐Z(Na2CO3)组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2,下列说法错误的是
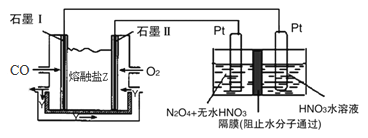
A. 石墨I是原电池的负极,发生氧化反应 B. 甲池中的CO32-向石墨I极移动
C. 乙池中左端Pt极电极反应式:N2O4-2e-+2HNO3=2N2O5+2H+ D. 若甲池消耗标准状况下的氧气2.24L,则乙池中产生氢气0.05mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017河南模拟】一定温度下,在3个体积均为l.0L的恒容密闭容器中反应2H2(g)+CO(g)CH3OH(g)分别达到平衡.下列说法正确的是( )
容器 | 温度(K) | 起始浓度(mol/L) | CH3OH的平衡浓度(mol/L) | ||
H2 | CO | CH3OH | |||
① | 400 | 0.20 | 0.10 | 0 | 0.08 |
② | 400 | 0.40 | 0.20 | 0 | x |
③ | 500 | 0 | 0 | 0.10 | 0.025 |
A.该反应的正反应是吸热反应
B.X=0.16
C.平衡时,容器②中H2的体积分数比容器①的大
D.400K时若再向容器①中充入0.10molH2、0.10molCO和0.10molCH3OH,则平衡将向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断下列有关化学基本概念的依据正确的是( )
A. 溶液与胶体:本质不同的原因是能否发生丁达尔效应
B. 氧化还原反应:有元素化合价升降的反应
C. 强弱电解质:溶液的导电能力大小
D. 共价化合物:是否含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分散系均能发生丁达尔现象的选项( )
A. 酒、生理盐水、花生油 B. 雾、含灰尘颗粒的空气、有色玻璃
C. 水晶、金刚石、冰 D. 大理石、高岭石、电石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017金凤区校级三模】一定的条件下,合成氨反应为:N2(g)+3H2(g)2NH3(g).图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线.图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响.
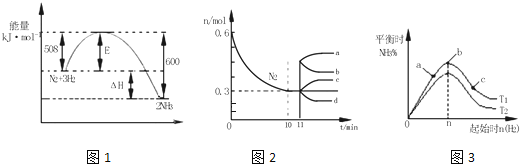
①由图2信息,计算0~10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 ;
②图3a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017宁波模拟】己知反应:2Al(l) ![]() B(l)△H=﹣QkJ/mol,取等量A分别在0℃和20℃下反应,测得其转化率Y随时间t变化的关系曲线(Y﹣t)如图所示.下列说法正确的是( )
B(l)△H=﹣QkJ/mol,取等量A分别在0℃和20℃下反应,测得其转化率Y随时间t变化的关系曲线(Y﹣t)如图所示.下列说法正确的是( )

A.a代表20℃下A的Y﹣t曲线
B.反应到66min时,0℃和20℃下反应放出的热量相等
C.0℃和20℃下达到平衡时,反应都放出QkJ热量
D.反应都达到平衡后,正反应速率a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO3可被过量KIO3氧化,当NaHSO3完全消耗时才有I2析出。某课题组用0.02mol/LNaHSO3溶液和0.02mol/L KIO3溶液,以及淀粉作指示剂,通过测定溶液变蓝所用时间来探究影响化学反应速率的因素。
(1)写出NaHSO3溶液与过量KIO3溶液反应生成I2的离子方程式:__________________________。
(2)调节反应物浓度和温度进行对比实验,记录结果如下:
编号 | NaHSO3溶液(mL) | KIO3溶液(mL) | H2O(mL) | 反应温度(℃)/ | 变蓝时间(t/s) |
① | 10 | 15 | a | 10 | t1 |
② | 10 | 40 | 0 | 10 | t2 |
③ | 10 | b | 0 | 20 | t3 |
表中a=_________,b=_________。
(3)改变反应温度,重复实验③,得到温度(T)与溶液变蓝所需时间(t)的关系如下图所示(“×××”表示超过50℃后溶液不会再变蓝)。

①在30℃下,若溶液变蓝时,I2的物质的量为n mol,则从反应开始至溶液变蓝,IO3-的平均反应速率为_______mol·L-1·s-1(写出表达式即可,不要化简)。
②根据图像,请你描述低于50℃时,溶液变蓝所需时间与反应温度的关系:__________________。
(4)将NaHSO3溶液与KIO3溶液混合(预先加入可溶性淀粉为指示剂),用速率检测仪检测出起始阶段反应速率逐渐增大,一段时间后反应速率又逐渐减小。课题组在排除浓度、温度等影响因素后,对起始阶段反应速率逐渐增大的原因提出如下假设,请你完成假设二:
假设一:反应生成的I2对反应起催化作用;I2浓度越大反应速率越快;
假设二:________________________________________________________;
假设三:________________________________________________________;
(5)请你设计实验验证上述假设一,完成下表中内容(反应速率可用测速仪测定)。
实验方案 | 预期实验现象和结论 |
第一步:在烧杯甲中将NaHSO3溶液与过量KIO3 溶液混合, 用测速仪测定起始时的反应速率V(甲) 第二步:在烧杯乙中________________________,测定其起始阶段的相同时间内的反应速率V(乙) | 若__________,则假 设一成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的NaX、NaY和NaZ溶液,其pH依次为7、9、11,则HX、HY、HZ的酸性由强到弱的顺序是( )
A.HX HY HZB.HX HZ HYC.HZ HY HXD.HY HZ HX
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com