分析:(1)由题目信息可知,CO
2(g)与H
2(g)反应生成CH
3OH(g)和H
2O(g).由表中数据可知10min起氢气的浓度不再变化,所以为可逆反应.据此书写方程式;
由表中数据可知氢气的起始浓度为0.40mol/L,平衡浓度为0.04mol/L,据此计算出氢气的物质的量的变化量,结合放出的反应热,计算出3mol氢气反应放出的热量.注意反应热数值与化学计量数有关,根据v=
计算v(H
2),再利用速率之比等于化学计量数之比计算v(CH
3OH);
(2)A、该反应为放热反应,升高温度,平衡向逆反应方向移动;
B、充入Ar使压强增大,体积不变,反应混合气体浓度不变,平衡不移动;
C、等效为开始充入1.5a mol CO
2和1.5a mol H
2,体积变为原来1.5倍,平衡后再将体积压缩为原来体积.增大压强平衡向体积减小的方向移动;
D、将水从平衡体系中分离出来,生成物的浓度降低,平衡向正反应移动;
(3)由表中数据可知氢气的起始浓度为0.40mol/L,据此计算a的值,
平衡常数指生成物浓度的系数次幂之积与反应物浓度系数次幂之积的比值,平衡常数k=
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
,根据三段式求出各组分的浓度变化量、平衡时各组分的浓度,代入平衡常数计算;
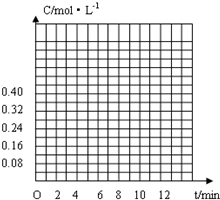
(4)由方程式判断CO
2和H
2的浓度变化关系,计算平衡时CO
2和H
2的浓度,注意二者的起始浓度,据此作图.
解答:解:(1)CO
2(g)与H
2(g)反应生成CH
3OH(g)和H
2O(g).由表中数据可知10min起氢气的浓度不再变化,且不为0,所以为可逆反应.反应方程式为CO
2+3H
2
CH
3OH+H
2O.
由表中数据可知氢气的起始浓度为0.40mol/L,平衡浓度为0.04mol/L,所以参加反应的氢气的物质的量为
(0.40mol/L-0.04mol/L)×10L=3.6mol,所以3mol氢气反应放出的热量为
×58.8kJ=49kJ,所以则上述反应的CO
2+3H
2
CH
3OH+H
2O的反应热△H=-49kJ/mol.
由表中数据可知10min内△c(H
2)=0.40mol/L-0.04mol/L=0.36mol/L,所以v(H
2)=
=0.036mol/(L?min).
速率之比等于化学计量数之比,所以v(CH
3OH)=
v(H
2)=
×0.036mol/(L?min)=0.012mol/(L?min),
故答案为:CO
2+3H
2
CH
3OH+H
2O;-49kJ/mol;0.012mol/(L?min);
(2)A、该反应为放热反应,升高温度,平衡向逆反应方向移动,c(CH
3OH)减小,c(CO
2)增大,所以
减小,故A错误;
B、充入Ar使压强增大,体积不变,反应混合气体浓度不变,平衡不移动.所以
不变,故B错误;
C、等效为开始充入1.5a mol CO
2和1.5a mol H
2,体积变为原来1.5倍,平衡后再将体积压缩为原来体积.增大压强平衡向体积减小的方向移动,即向正反应移动,c(CH
3OH)增大,c(CO
2)减小,所以
增大,故C正确;
D、将水从平衡体系中分离出来,生成物的浓度降低,平衡向正反应移动.c(CH
3OH)增大,c(CO
2)减小,所以
增大,故D正确.
故选:CD;
(3)由表中数据可知氢气的起始浓度为0.40mol/L,所以a=0.40mol/L×10L=4mol.
根据三段式求出各组分的浓度变化量、平衡时各组分的浓度,
由表中数据可知氢气的起始浓度为0.40mol/L,所以二氧化碳的起始浓度也为0.40mol/L,平衡时氢气浓度为0.04mol/L,
对于反应 CO
2(g)+3H
2(g)

CH
3OH(g)+H
2O(g)
开始(mol/L):0.4 0.4 0 0
变化(mol/L):0.12 0.4-0.04=0.36 0.12 0.12
平衡(mol/L):0.28 0.04 0.12 0.12
所以平衡常数k=
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
=
=803.6,
故答案为:4mol;803.6;
(4)由(3)计算可知,二氧化碳、氢气的起始浓度为0.40mol/L.氢气的平衡浓度为0.04mol/L,二氧化碳的平衡浓度为0.28mol/L.
由方程式 CO
2(g)+3H
2(g)

CH
3OH(g)+H
2O(g)可知,相同时间内H
2的浓度变化是CO
2浓度变化的3倍,再根据表中氢气各时刻的浓度,计算二氧化碳的各时刻浓度.
作图如图所示:

,故答案为:

.

 哥本哈根会议虽未能就减排问题达成有约束力的协议,但各国对于CO2对气候的影响达成了共识,都在积极研究方法循环利用CO2.CO2(g)与H2(g)反应可生成CH3OH(g)和H2O(g).某实验小组为研究该反应进行了如下实验.在某温度下,向容积为10L的恒温恒容容器中充入a mol CO2和a mol H2,测得不同时刻的c(H2)如右表.
哥本哈根会议虽未能就减排问题达成有约束力的协议,但各国对于CO2对气候的影响达成了共识,都在积极研究方法循环利用CO2.CO2(g)与H2(g)反应可生成CH3OH(g)和H2O(g).某实验小组为研究该反应进行了如下实验.在某温度下,向容积为10L的恒温恒容容器中充入a mol CO2和a mol H2,测得不同时刻的c(H2)如右表. CH3OH+H2O
CH3OH+H2O CH3OH+H2O
CH3OH+H2O CH3OH+H2O.
CH3OH+H2O. CH3OH+H2O的反应热△H=-49kJ/mol.
CH3OH+H2O的反应热△H=-49kJ/mol. CH3OH+H2O;-49kJ/mol;0.012mol/(L?min);
CH3OH+H2O;-49kJ/mol;0.012mol/(L?min); CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) CH3OH(g)+H2O(g)可知,相同时间内H2的浓度变化是CO2浓度变化的3倍,再根据表中氢气各时刻的浓度,计算二氧化碳的各时刻浓度.
CH3OH(g)+H2O(g)可知,相同时间内H2的浓度变化是CO2浓度变化的3倍,再根据表中氢气各时刻的浓度,计算二氧化碳的各时刻浓度. ,故答案为:
,故答案为: .
.



 增大的是 (填字母).
增大的是 (填字母).