
【题目】根据下列5种元素的电离能数据![]() 单位:
单位:![]()
元素符号 |
|
|
|
|
Q | 2080 | 4000 | 6100 | 9400 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
V | 420 | 3100 | 4400 | 5900 |
它们的氯化物的化学式,最可能正确的是
A.![]() B.RClC.
B.RClC.![]() D.TCl
D.TCl
科目:高中化学 来源: 题型:
【题目】实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250 mL溶液。
方案一:沉淀法。利用化学反应把HCO3—、CO32—完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中ω(Na2CO3)。
(1)量取100 mL配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3—、CO32—完全转化为沉淀,应选用的试剂是 (填编号)。
A.CaCl2溶液 B.MgSO4溶液 C.NaCl溶液 D.Ba(OH)2溶液
(2)过滤,提取沉淀,则过滤操作所需要的玻璃仪器除烧杯外,还有 。
(3)将沉淀洗涤,并充分干燥,称量沉淀的质量为mg,由此可以计算(Na2CO3)。如果此步中,沉淀未干燥充分就称量,则测得ω(Na2CO3) (填“偏大”、“偏小"或“无影响")。
方案二:量气法。量取10.00 mL配制好的溶液与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃、1.01×105 Pa)的体积,由此计算混合物中W(Na2CO3)。

(1)装置中导管a的作用是 。若撤去导管a,使测得气体体积 (“偏大”,“偏小”或“无影响”)
(2)反应结束后,为了准确地测量气体体积,量气管在读数时应注意:
① ,② ,
③眼睛视线与液面最低处相平。
(3)实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生CO2的体积为 ml。
方案三:滴定法。量取25.00 mL配制好的溶液加入锥形瓶中,滴加2滴酚酞试剂,摇匀,用0.2000 mol/L的盐酸滴定到终点(已知终点时反应H++CO32—=HCO3—恰好完全)。重复此操作2次,消耗盐酸的体积平均值为20.00 mL。
(1)量取25.00 mL配制好的溶液,应选择 仪器来完成。
(2)判断滴定终点的依据是 。
(3)此法测得ω(Na2CO3)= %。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I .甲、乙、丙3位同学,在已知盐酸是强酸的基础上,通过实验验证醋酸是弱酸,分别设计了如下实验方案:
甲:分别准确配制0.1 mol/L的盐酸和醋酸各250 mL,再用pH试纸分别测定两溶液的pH。
乙:分别准确配制0.1 mol/L的盐酸和醋酸各250 mL。各取出20 mL于锥形瓶中,逐滴加入0.1 mol/L标准NaOH溶液(不需配制),分别记录恰好中和时用去NaOH溶液的体积。
丙:分别准确配制pH=1的盐酸和醋酸各250 mL。各取出10 mL加水稀释到100 mL后比较稀释后溶液的pH。回答下列问题:
(1)甲同学的实验结果为盐酸和醋酸的pH分别为pH1和pH2,则pH1_____pH2(填“>”“<”或“=”),所以此实验方案________(填“可行”或“不可行”)。
(2)乙同学的实验结果为盐酸和醋酸分别用去NaOH溶液V1 mL和V2 mL,则V1____V2(填“>”“<”或“=”),所以此实验方案______(填“可行”或“不可行”)。
(3)丙同学的实验方案不可行的原因是____________________________________。
II. 测定Na2S2O3样品纯度。
取10.0 g Na2S2O3·5H2O样品,配成 250mL溶液,准确量取25.00 mL溶液,以淀粉作指示剂,用0.1000 mol·L-1碘的标准溶液滴定。三次平行实验测得的数据如下:
实验序号 | 消耗标准溶液体积/mL |
1 | 19.98 |
2 | 17.90 |
3 | 18.10 |
已知:2Na2S2O3+I2=Na2S4O6+2NaI
①滴定终点的颜色为__________________。
②该Na2S2O3·5H2O样品的纯度为___%(保留2位小数)(已知Na2S2O3·5H2O的M=248g mol·-1)。
③若样品中含Na2SO3(还原性:SO32->I-),则测得的结果_______(填“偏高”“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于价电子构型为4s24p4的基态原子描述正确的是( )
A. 它的元素名称为锡 B. 它的核外电子排布式为[Ar]4s24p4
C. 它的第一电离能小于As D. 其外围电子排布图为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有3种元素的基态原子的电子排布式如下:①![]() ,②
,②![]() ,③
,③![]() 。则下列有关比较中正确的是
。则下列有关比较中正确的是
A.第一电离能:③>②>①B.原子半径:①>②>③
C.电负性:③>②>①D.最高正化合价:②>①>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,20mL某气态烃与过量氧气混合,将完全燃烧后的产物通过浓硫酸,再恢复至室温,气体体积减少了50mL,将剩余气体再通过氢氧化钠溶液,体积又减少了40mL,求该气态烃的分子式( )
A.CH4B.C2H6C.C2H4D.C2H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧ag液态乙醇生成二氧化碳气体和液态水,放出QkJ热量,经测定ag液态乙醇与足量钠 反应生成标准状况下5.6L氢气。则液态乙醇燃烧的热化学方程式表示正确的是( )
A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-QkJ·mol-1
B.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-2QkJ·mol-1
C.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-2QkJ·mol-1
D.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=+QkJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,不能达到实验目的是( )
A. 图1:实验室制备Fe(OH)2
图1:实验室制备Fe(OH)2
B. 图2:收集NO气体
图2:收集NO气体
C.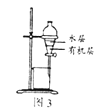 图3:所示装置分离CCl4萃取溴水后已分层的有机层和水层
图3:所示装置分离CCl4萃取溴水后已分层的有机层和水层
D. 图4:可证明NH4NO3溶解时需要吸收热量
图4:可证明NH4NO3溶解时需要吸收热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用图1 和图2中的信息,按图3装置(连接的A、B瓶中已充有NO2气体)进行实验。下列说法正确的是

A. H2O2中只含有极性共价键,不含离子键
B. 2NO2![]() N2O4的平衡常数K随温度升高而减小
N2O4的平衡常数K随温度升高而减小
C. 向H2O2中加入Fe2(SO4)3后,B中颜色变浅
D. H2O2分解反应中Fe2(SO4)3作催化剂,可以使反应的△H减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com