
(本题共12分)
我国钾长石(KAlSi3O8)的资源比较丰富。工业上可用食盐和钾长石在一定条件下制备氯化钾:NaCl (l) +KAlSi3O8 (s)  KCl (l)+NaAlSi3O8 (s)。
KCl (l)+NaAlSi3O8 (s)。
完成下列填空:
(1)硅原子的最外层电子占据了 个轨道,有 种能量。
(2)氯化钠的熔点比氯化钾的 (填“高”或“低”),原因是 。
(3)把反应中涉及到的六种元素的原子半径按从小到大的顺序排列 。
(4)参与上述反应且位于同一周期的几种元素中,有一种元素的最高价氧化物的水化物和其余元素的最高价氧化物的水化物均能发生反应,这种元素是 。
(5)为研究上述反应中钾元素的熔出率(液体中钾元素的质量占全部钾元素质量的百分率)与温度的关系,进行实验(氯化钠与钾长石投料的质量比为2:1),获得如下数据:
| 时间(h) 钾元素 温度 熔出率 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 |
| 890℃ | 0.579 | 0.691 | 0.694 | 0.699 | 0.699 |
| 950℃ | 0.669 | 0.714 | 0.714 | 0.714 | 0.714 |
(1)3 2
(2)高 钾离子半径大于钠离子,半径越大,离子键键能越低,熔点越低。
(3)O<Cl<Si<Al<Na<K
(4)Na
(5)①吸热 ②0.074 ③充分搅拌 将钾长石充分粉碎
解析试题分析:(1)硅原子的最外层电子排布式为3S23P2占据了3个轨道,有2种能量。
(2)钾离子半径大于钠离子,半径越大,离子键键能越低,熔点越低。氯化钠的熔点比氯化钾的高。
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,电子层越多原子半径越大,故原子半径K>Na>Al>Si>Cl>O。
(4)Na、Al、Si、Cl四种元素处于同一周期,氢氧化钠能与氢氧化铝、硅酸、高氯酸反应生成相应的盐与水,故答案为:Na;
(5)①由表中数据可知,温度越高钾元素的熔出率,说明升高温度,平衡向正反应方向移动,升高温度平衡向吸热方向移动,故正反应为吸热反应,故答案为:吸热;② 1gKAlSi3O8 (s)中K的质量为:39/278=0.140g,
NaCl (l) +KAlSi3O8 (s)  KCl (l)+NaAlSi3O8 (s)。
KCl (l)+NaAlSi3O8 (s)。
开始 2g 1g 0
平衡 0.699*74.5*0.140/39
转化 0.699*74.5*58.5*0.140/39*74.5 0.699*74.5/39
求得 0.699*74.5*58.5*0.140/39*74.5 =0.148,氯化钠的平衡转化率=0.148/2=0.074。
③950℃时,提高熔出钾的速率可以采取的措施是充分搅拌,反应物充分接触,反应速率加快,或将钾长石粉粹成更小的颗粒,增大反应物的接触面积,反应速率加快。
考点:本题考查电子排布式书写、原子半径比较、化学平衡影响元素等。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:填空题
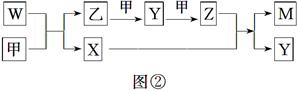
A、B、D、E四种元素均为短周期元素,原子序数逐渐增大。A元素原子的核外电子数、电子层数和最外层电子数均相等。B、D、E三种元素在周期表中的相对位置如图①所示,只有E元素的单质能与水反应生成两种酸。甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子。它们之间的转化关系如图②所示。
| B | D | |
| | | E |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。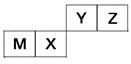
请回答下列问题:
(1)这些元素的氢化物中,水溶液碱性最强的是________(写化学式),该氢化物的电子式为________。
(2)元素X和元素Y的最高价氧化物对应水化物的酸性较弱的是________,列举一个化学方程式证明________________________。
(3)元素Z与元素M组成的化合物中所含化学键类型为________,元素Z与元素X组成的化合物中所含化学键类型为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大。已知:A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,D与E同主族,E元素原子的最外层电子数比次外层电子数少2。请回答:
(1)元素C在周期表中的位置是________。
(2)元素D的单质与金属钠反应生成的化合物可作潜水面具中的供氧剂,这种化合物与水反应的离子方程式________________________________。
(3)D和E两种元素相比较,其原子得电子能力较强的是________(写名称)。
以下说法中,可以证明上述结论的是__________(填写编号)。
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素氢化物的水溶液的酸性
(4)元素A、D、E与钠元素可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中反应的离子方程式是____________________________。
(5)由元素A、B、D组成的一元酸X为日常生活中的调味剂,元素A、F组成的化合物为Y。在等体积、等pH的X、Y的溶液中分别加入等质量的锌粉,反应后若最后仅有一份溶液中存在锌粉,则反应过程中两溶液中反应速率的大小关系是:X________Y(填“>”、“=”或“<”)。
(6)元素F的单质常温下是一种气体,工业上主要是通过电解其钠盐的饱和溶液的方法获得该气体,假定装入的饱和溶液为100 mL(电解前后溶液体积变化可忽略),当测得阴极上产生11.2 mL(标准状况)气体时停止通电,将溶液摇匀,此时溶液的pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表列出了A-R 9种元素在周期表中的位置
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | | | | E | | F | | |
| 3 | A | C | D | | | | G | R |
| 4 | B | | | | | | H | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
回答以下关于第三周期元素及其化合物的问题。
(1)下列能用于判断氧和氟非金属性强弱的是 (选填编号)。
A.气态氢化物的稳定性 B.最高价氧化物对应水化物的酸性
C.单质与氢气反应的难易 D.单质与同浓度酸发生反应的快慢
(2)Be和Al具有相似的化学性质,写出BeCl2水解反应的化学方程式
(3)常温下,不能与铝单质发生反应的是_________(填序号)
A.CuSO4溶液 B.Fe2O3 C.浓硫酸 D.NaOH E.Na2CO3固体
(4)相同压强下,部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/℃ | 1266 | 1534 | 183 |
 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、D、E、G六种短周期元素的原子序数依次递增。X、Y、D元素的基态原子中电子层数与未成对电子数均相等;D、E属于同族元素,G的单质和ED2化合物均具有漂白性;R元素的M层全满,N层只有1个电子。
请回答下列问题:(用对应的元素符号表示)
(1)R元素在元素周期表分区中属于______区元素,Y、Z、D三种元素中电负性由小到大的顺序是_________。
(2)X3D+的中心原子杂化轨道类型是__________,该离子的立体构型是 。
(3)向RED4的水溶液中加入ZX3的水溶液至过量,有关反应的离子方程式是 。
(4)向RG2的水溶液通入ED2,产生白色沉淀RG,该反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知A原子只有一个未成对电子,M电子层比N电子层多11个电子,试回答下列问题:
(1)该元素的基态原子有 个能层充有电子;
(2)写出A原子的电子排布式和元素符号 ; 。
(3)指出元素A在周期表中的位置 。
(4)指出元素A的最高化合价 。
(5)A的氢化物分子中共价键的类型可能有 。
①s-pσ键 ②p-pσ键 ③s-s σ键 ④p-pπ键
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。
请回答下列问题:
(1)元素D在周期表中的位置_______________________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)___________.
(3)由A、B、C三种元素以原子个数比4 :2 :3形成化合物X,X中所含化学键类型有________________.
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:____________;若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:________________。
(5)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com