
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(g) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
| △c |
| △t |
| c(CO2)?c2(H2) |
| c(H2O) |
| 0.8×1.62 |
| 0.42 |
| x |
| 2 |
| x |
| 2 |
| x |
| 2 |
| x |
| 2 |
| n |
| V |
| 1.2 |
| 1 |
| △c |
| △t |
| 1.2 mol/L |
| 3min |
| 1 |
| K |


科目:高中化学 来源:2010届靖江高级中学高三第三次模拟考试化学试题 题型:填空题
(8分)江苏连云港开发硅产业比较发达,粗硅提纯经常用“三氯氢硅法”。将干燥的硅粉加入合成炉中,与通入的干燥氯化氢气体在280~330℃有氯化亚铜催化剂存在下进行氯化反应,反应气体旋风分离除去杂质,再用氯化钙冷冻盐水将气态三氯氢硅冷凝成液体,经粗馏塔蒸馏和冷凝,除去高沸物和低沸物,再经精馏塔蒸馏和冷凝,得到精制三氯氢硅液体。纯度达到七个“9”以上,杂质含量小于1×10-7,硼要求在0.5×10-9以下。提纯后的三氯氢硅送入不锈钢制的还原炉内,用超纯氢气作还原剂,在1050~1100℃还原成硅,并以硅芯棒为载体沉积而得多晶硅成品。其反应式如下:
Ⅰ H2+Cl2 =" 2HCl"
Ⅱ Si(粗)+3HCl(g)= SiHCl3(l)+H2(g)
Ⅲ SiHCl3(l) +H2(g) = Si(纯)+3HCl(g)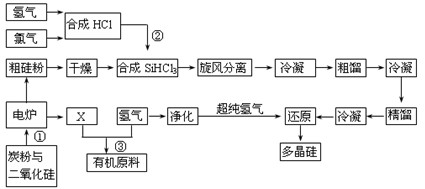
据以上材料回答问题:
(1)电炉中发生反应后排出气体X的成份 (填化学式)。
(2)目前提倡“低碳类经济”,CO2的吸收转化成有机物可有效实现碳循环,是节能减排的有效措施。某物质y的核磁共振氢谱只有一个峰,与CO2可催化加聚生成自然降解的
塑料聚碳酸酯,其反应方程式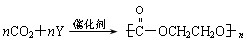 则Y的结构简式为 。
则Y的结构简式为 。
(3)在上述流程中可以循环使用的物质是 。(填名称)
(4)SiH4化学性质比较活泼,它在空气中自燃,有强还原性,在碱存在下迅速水解,由SiH4为原料进行氮化来制备Si3N4纳米材料,则你认为该材料中最大可能存在的杂质
(填化学式)。
(5)已知化学键如表
则下述反应 SiCl4(g)+2H2(g) Si(s)+4HCl(g)
Si(s)+4HCl(g)
该反应的反应热 △H= kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
2009年12月7日~18日在丹麦首都哥本哈根召开了世界气候大会,商讨《京都议定书》一期承诺到期后的后续方案,即2012年至2020年的全球减排协议,大会倡导“节能减排” 和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。过渡排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
 CO2(g)+3H2(g)
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ·mol-1)的变化:

(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),经测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),经测得CO2和CH3OH(g)的浓度随时间变化如图所示。

从反应开始到平衡,CO2的平均反应速率v(CO2) = 。
② 该反应的平衡常数表达式K= 。
③ 下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l molCO2和3 molH2
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出369.2kJ的热量,写出该反应的热化学方程式:___________________________________________。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入或通入的物质有__________ _____;其正极的电极反应式是:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
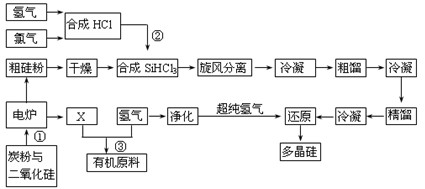
江苏连云港开发硅产业比较发达,粗硅提纯经常用“三氯氢硅法”。将干燥的硅粉加入合成炉中,与通入的干燥氯化氢气体在280~330℃有氯化亚铜催化剂存在下进行氯化反应,反应气体旋风分离除去杂质,再用氯化钙冷冻盐水将气态三氯氢硅冷凝成液体,经粗馏塔蒸馏和冷凝,除去高沸物和低沸物,再经精馏塔蒸馏和冷凝,得到精制三氯氢硅液体。纯度达到七个“9”以上,杂质含量小于1×10-7,硼要求在0.5×10-9以下。提纯后的三氯氢硅送入不锈钢制的还原炉内,用超纯氢气作还原剂,在1050~1100℃还原成硅,并以硅芯棒为载体沉积而得多晶硅成品。其反应式如下:
Ⅰ H2+Cl2 = 2HCl
Ⅱ Si(粗)+3HCl(g)= SiHCl3(l)+H2(g)
Ⅲ SiHCl3(l) +H2(g) = Si(纯)+3HCl(g)
据以上材料回答问题:
(1)电炉中发生反应后排出气体X的成份 (填化学式)。
(2)目前提倡“低碳类经济”,CO2的吸收转化成有机物可有效实现碳循环,是节能减排的有效措施。某物质y的核磁共振氢谱只有一个峰,与CO2可催化加聚生成自然降解的
塑料聚碳酸酯,其反应方程式![]() 则Y的结构简式为 。
则Y的结构简式为 。
(3)在上述流程中可以循环使用的物质是 。(填名称)
(4)SiH4化学性质比较活泼,它在空气中自燃,有强还原性,在碱存在下迅速水解,由SiH4为原料进行氮化来制备Si3N4纳米材料,则你认为该材料中最大可能存在的杂质
(填化学式)。
(5)已知化学键如表

则下述反应 SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g)
Si(s)+4HCl(g)
该反应的反应热 △H= kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com