
下列各物质不能与CO![]() 反应的是( )
反应的是( )
①Li![]() O②Na
O②Na![]() O
O![]() ③Na
③Na![]() CO
CO![]() 溶液④NaHCO
溶液④NaHCO![]() 溶液
溶液
⑤Ca(OH)![]() 溶液⑥CaCl
溶液⑥CaCl![]() 溶液
溶液
A.①③④ B.②⑤⑥ C.④⑥ D.①⑥
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
 Fe2++Ag+,请回答下列问题:
Fe2++Ag+,请回答下列问题: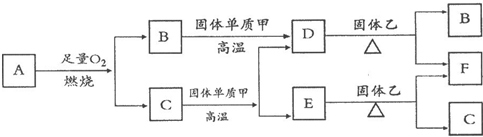
查看答案和解析>>
科目:高中化学 来源: 题型:
物质 T/℃n/mol T/℃ |
活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
| 9 |
| 16 |
| 9 |
| 16 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
①Li![]() O ②Na
O ②Na![]() O
O![]() ③Na
③Na![]() CO
CO![]() 溶液 ④NaHCO
溶液 ④NaHCO![]() 溶液 ⑤Ca(OH)
溶液 ⑤Ca(OH)![]() 溶液 ⑥CaCl
溶液 ⑥CaCl![]() 溶液
溶液
A.①③④ B.②⑤⑥ C.④⑥ D.①⑥
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物。
(1)上述3种气体直接排入空气后会引起酸雨的气体有 (填化学式)。
(2)早期人们曾经使用铅室法生产硫酸,其主要反应为:
SO2(g)+NO2(g)![]() SO3(g)+NO(g)
SO3(g)+NO(g)
①若已知2SO2(g)+O2(g)![]() 2SO3(g) ΔH=a kJ·mol-1
2SO3(g) ΔH=a kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=b kJ·mol-1
2NO2(g) ΔH=b kJ·mol-1
则SO2(g)+NO2(g)![]() SO3(g)+NO(g) ΔH= kJ·mol-1。
SO3(g)+NO(g) ΔH= kJ·mol-1。
②一定温度下,向固定体积为2 L的密闭容器中充入SO2和NO2各1 mol,发生反应:
SO2(g)+NO2(g)![]() SO3(g)+NO(g)
SO3(g)+NO(g)
下列事实中不能说明该反应达到平衡状态的是 (选填序号)。
a.体系压强保持不变 b.混合气体的颜色保持不变
c.NO的物质的量保持不变 d.每生成1 mol SO3的同时消耗1 mol NO2
③测得②中反应5 min末到达平衡,此时容器中NO与NO2的体积比为3︰1,则这段时间内SO2的反应速率υ(SO2)= ,此反应在该温度下的平衡常数K= 。
(3)甲醇日趋成为重要的有机燃料,通常利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
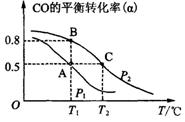
①上述合成甲醇的反应为 反应(填“放热”或“吸热”)。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为 。
③若将达到平衡状态A时生成的甲醇用于构成甲醇一氧气燃料电池,电解质溶液为KOH浓溶液,则该电池工作时正极的电极反应式为 ,理论上通过外电路的电子最多为 mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com