
二甲醚(CH3OCH3)是一种重要的精细化工产品,被认为是二十一世纪最有潜力的燃料(已知:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(1)△H=-1455KJ/mol)。同时它也可以作为制冷剂而替代氟氯代烃。工业上制备二甲醚的主要方法经历了三个阶段:
①甲醇液体在浓硫酸作用下或甲醇气体在催化作用下直接脱水制二甲醚;
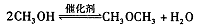
②合成气CO与H2直合成二甲醚:
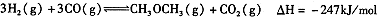
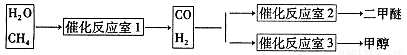
③天然气与水蒸气反应制备二甲醚。以CH4和H20为原料制备二甲醚和甲醇工业流程如下:
(1)写出CO(g)、H2(g)、O2(g)反应生成CO2(g)和H2O(1)的热化学方程式 。
(2)①方法中用甲醇液体与浓硫酸作用直接脱水制二甲醚,尽管产率高,但是逐步被淘汰的主要原因是 。
(3)在反应室2中,一定条件下发生反应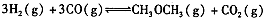 在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是____。
在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是____。
A.低温高压 B.加催化剂 C.增加CO浓度 D.分离出二甲醚
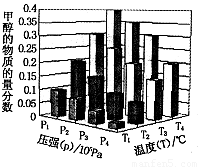
(4)在反应室3中,在一定温度和压强条件下发生了反应: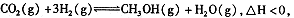 反应达到平衡时,改变温度(T)和压强(P),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(P)的关系判断正确的是 .(填序号)。
反应达到平衡时,改变温度(T)和压强(P),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(P)的关系判断正确的是 .(填序号)。
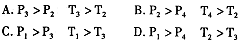
(5)反应室1中发生反应: 写出平衡常数的表达式: 。如果温度降低,该反应的平衡常数 。(填“不变”、
写出平衡常数的表达式: 。如果温度降低,该反应的平衡常数 。(填“不变”、
“变大”、“变小”)
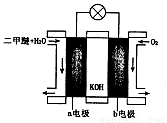
(6)下图为绿色电源“二甲醚燃料电池”的工作原理示意图。则a电极的反应式为:_ ___。
14分
⑴CO(g)+H2(g)+O2(g)=CO2(g)+H2O(l) ΔH=-567.3KJ/mol (2分)
⑵浓硫酸对设备腐蚀性严重,环境污染严重,操作条件恶劣。 (2分)
⑶A D (2分)
⑷C D (2分
⑸K=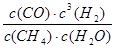 (2分),变小(1分)
(2分),变小(1分)
⑹(CH3)2O-12e-+16OH-=2CO32-+11H2O (3分)
【解析】
试题分析:⑴已知①CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(1)△H=-1455KJ/mol
②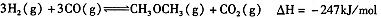
(①+②)÷3得:CO(g)+H2(g)+O2(g)=CO2(g)+H2O(l) ΔH=-567.3KJ/mol 。
⑵浓硫酸对设备腐蚀性严重,环境污染严重,操作条件恶劣。
⑶由勒夏特列原理选A D
⑷由该反应热化学方程式及勒夏特列原理知:加压,平衡正向移动,n(CH3OH)增大,故P1>P3;升温,平衡逆向移动,n(CH3OH)减小,故T1>T3,选CD。
⑸K=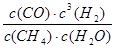 ,因为正反应吸热,故如果温度降低,该反应的平衡常数变小。
,因为正反应吸热,故如果温度降低,该反应的平衡常数变小。
⑹a电极是负极,在碱性条件下甲醚应被氧化为CO32-,电极反应式为(CH3)2O-12e-+16OH-=2CO32-+11H2O
考点:盖斯定律、化工反应条件选择、化学平衡及平衡常数、原电池


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 0.28 | 0.86 | 0.86 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省无锡市高三上学期期末考试化学试卷 题型:填空题
(14分)二甲醚(CH3OCH。)和甲醇(CH3OH)被称为21世纪的新型燃料,具有清洁、高效等优良的性能。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:

(1)催化反应室B中CO与H2合成二甲醚的化学方程式为 .
(2)催化反应室A中发生的反应为:
CH4(g)+H2O(g) CO(g)+3H2(g)……(I)、CO(g)+H2O(g)
CO(g)+3H2(g)……(I)、CO(g)+H2O(g) CO2(g)+H2(g)……(Ⅱ)催化反应室C中发生的反应为:
CO2(g)+H2(g)……(Ⅱ)催化反应室C中发生的反应为:
CO(g)+2H2(g) CH3OH(g)……(Ⅲ)、CO2(g)+3H2(g)
CH3OH(g)……(Ⅲ)、CO2(g)+3H2(g) CH3OH(g)+H2O(g)……(Ⅳ)
CH3OH(g)+H2O(g)……(Ⅳ)
①已知:原子利用率= ×100%,试求反应(Ⅳ)的原子利用率为 。
×100%,试求反应(Ⅳ)的原子利用率为 。
②反应(Ⅳ)的△S 0(填“>”、“=”或“<”)。
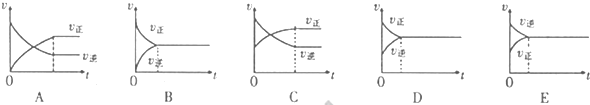
③在压强为5MPa,体积为VL的反应室c中,amol CO与20mol H2在催化剂作用下发生反应(Ⅲ)生成甲醇,CO的转化率与温度的关系如右图。则该反应的△H 0(填“>”、“=”或“<”)。300℃时该反应的平衡常数K= (用含字母的代数式表示)。

(3)我国某科研所提供一种碱性“直接二甲醚燃料电池”。
该燃料电池负极的电极反应式为:
CH3OCH3一12e一+16OH一=2CO2-3+11H2O。有人提出了一种利用氯碱工业产品治理含二氧化硫(体积分数为x)废气的方法如下:
①将含SO2的废气通人电解饱和食盐水所得溶液中,得NaHSO3溶液;
②将电解饱和食盐水所得气体反应后制得盐酸;
③将盐酸加入NaHSO3溶液中得SO2气体回收。
用上述碱性“直接二甲醚燃料电池”电解食盐水来处理标准状况下VL的废气,计算消耗二甲醚的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)二甲醚(CH3OCH。)和甲醇(CH3OH)被称为21世纪的新型燃料,具有清洁、高效等优良的性能。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
(1)催化反应室B中CO与H2合成二甲醚的化学方程式为 .
(2)催化反应室A中发生的反应为:
CH4(g)+H2O(g)![]() CO(g)+3H2(g)……(I)、CO(g)+H2O(g)
CO(g)+3H2(g)……(I)、CO(g)+H2O(g)![]() CO2(g)+H2(g)……(Ⅱ)催化反应室C中发生的反应为:
CO2(g)+H2(g)……(Ⅱ)催化反应室C中发生的反应为:
CO(g)+2H2(g)![]() CH3OH(g)……(Ⅲ)、CO2(g)+3H2(g)
CH3OH(g)……(Ⅲ)、CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)……(Ⅳ)
CH3OH(g)+H2O(g)……(Ⅳ)
①已知:原子利用率= ×100%,试求反应(Ⅳ)的原子利用率为 。
×100%,试求反应(Ⅳ)的原子利用率为 。
②反应(Ⅳ)的△S 0(填“>”、“=”或“<”)。
③在压强为5MPa,体积为VL的反应室c中,amol CO与20mol H2在催化剂作用下发生反应(Ⅲ)生成甲醇,CO的转化率与温度的关系如右图。则该反应的△H 0(填“>”、“=”或“<”)。300℃时该反应的平衡常数K= (用含字母的代数式表示)。
(3)我国某科研所提供一种碱性“直接二甲醚燃料电池”。
该燃料电池负极的电极反应式为:
CH3OCH3一12e一+16OH一=2CO2-3+11H2O。有人提出了一种利用氯碱工业产品治理含二氧化硫(体积分数为x)废气的方法如下:
①将含SO2的废气通人电解饱和食盐水所得溶液中,得NaHSO3溶液;
②将电解饱和食盐水所得气体反应后制得盐酸;
③将盐酸加入NaHSO3溶液中得SO2气体回收。
用上述碱性“直接二甲醚燃料电池”电解食盐水来处理标准状况下VL的废气,计算消耗二甲醚的质量。
查看答案和解析>>
科目:高中化学 来源:2012届江苏省无锡市高三上学期期末考试化学试卷 题型:填空题
(14分)二甲醚(CH3OCH。)和甲醇(CH3OH)被称为21世纪的新型燃料,具有清洁、高效等优良的性能。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
(1)催化反应室B中CO 与H2合成二甲醚的化学方程式为 .
与H2合成二甲醚的化学方程式为 .
(2)催化反应室A中发生的反应为:
CH4(g)+H2O(g) CO(g)+3H2(g)……(I)、CO(g)+H2O(g)
CO(g)+3H2(g)……(I)、CO(g)+H2O(g) CO2(g)+H2(g)……(Ⅱ)催化反应室C中发生的反应为:
CO2(g)+H2(g)……(Ⅱ)催化反应室C中发生的反应为:
CO(g)+2H2(g) CH3OH(g)……(Ⅲ)、CO2(g)+3H2(g)
CH3OH(g)……(Ⅲ)、CO2(g)+3H2(g) CH3OH(g)+H2O(g)……(Ⅳ)
CH3OH(g)+H2O(g)……(Ⅳ)
①已知:原子利用率= ×100%,试求反应(Ⅳ)的原子利用率为 。
×100%,试求反应(Ⅳ)的原子利用率为 。
②反应(Ⅳ)的△S 0(填“>”、“=”或“<”)。
③在压强为5MPa,体积为VL的反应室c中,amol CO与20mol H2在催化剂作用下发生反应(Ⅲ)生成甲醇,CO的转化率与温度的关系如右图。则该反应的△H 0(填“>”、“=”或“<”)。300℃时该反应的平衡常数K= (用含字母的代数式表示)。
(3)我国某科研所提供一种碱性“直接二甲醚燃料电池”。
该燃料电池负极的电极反应式为:
CH3OCH3一12e一+16OH一=2CO2-3+11H2O。有人提出了一种利用氯碱工业产品治理含二氧化硫(体积分数为x)废气的方法如下:
①将含SO2的废气通人电解饱和食盐水所得溶液中,得NaHSO3溶液;
②将电解饱和食盐水所得气体反应后制得盐酸;
③将盐酸加入NaHSO3溶液中得SO2气体回 收。
收。
用上述碱性“直接二甲醚燃料电池”电解食盐水来处理标准状况下VL的废气,计算消耗二甲醚的质量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com