
将2.4 g镁、铝混合物粉末溶于75mL 4mol/L的盐酸中,反应一段时间后,再加入250mL 1.5mol/L的NaOH溶液,待反应完全,此时溶液中除Na+、Cl-外,还大量存在的是( )
A.AlO2- B.Al3+,Mg2+ C.Mg2+,AlO2- D.Al3+,Mg2+、H+
科目:高中化学 来源: 题型:
今有一混合物的水溶液,可能大量含有以下离子中的若干种:K+、NH4+、Cl—、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验,以下针对原溶液的推测正确的是
A.Cl—一定不存在 B.K+一定存在 C.Mg2+一定存在 D.Ba2+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应规律是化学学科的重要规律之一。按要求回答下列问题:
(1)被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O===NaBO2+4H2↑,此反应中B元素的化合价没有发生变化,则NaBH4中H的化合价为__________,该反应氧化产物是_______,还原产物是____________。
(2)有下列三个反应:
Cl2+FeI2===FeCl2+I2; 2Fe2++Br2===2Fe3++2Br-;
Co2O3+6HCl===2CoCl2+Cl2↑+3H2O
①根据以上方程式可以得到Fe2+、Co2+、Br-、I-还原性由强到弱的顺序为______________;
②1 mol Co2O3能氧化HCl的物质的量是__________________________________
(3)完成并配平下列化学反应方程式:
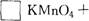



查看答案和解析>>
科目:高中化学 来源: 题型:
表示阿伏加德罗常数,下列叙述中正确的是
A.标准状况下,2.24L三氯甲烷含有分子数目为0.1
B.1 mol FeI2与足量氯气反应对转移的电子数为2
C.1 molCH3COONa 和少量CH3COOH溶于水所得中性溶液中,CH3COO-数目为
D.标准状况下,22.4L的乙烯中含有的共用电子对数为12
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下Cu2S与稀HNO3发生反应,所得还原产物为NO,氧化产物为Cu2+和SO42—。现将0.06molCu2S加入到50mL、4mol/LHNO3中,充分反应之后,下列说法正确的是( )
A.被还原的硝酸为0.2mol B.反应后溶液中仍有硝酸剩余
C.反应后溶液的pH=1 (溶液体积不变) D.Cu2S未全部参加反应
查看答案和解析>>
科目:高中化学 来源: 题型:
CH4和CO2反应可以制造价值更高的化学产品。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生反应:CO2 (g)+CH4(g)  2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
| 物 质 | CH4 | CO2 | CO | H2 |
| 平衡浓度(mol·L-1) | 0.5 | 0.5 | 2.0 | 2.0 |
① 此温度下,该反应的平衡常数K=________(注明单位).
② 已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H2 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H3 kJ·mol-1
反应CO2(g)+CH4(g)  2CO(g)+2H2(g) 的 △H=_______ kJ·mol-1
2CO(g)+2H2(g) 的 △H=_______ kJ·mol-1
(2)用Cu2Al2O4做催化剂,一定条件下,发生反应: CO2+CH4  CH3COOH, 请回答:
CH3COOH, 请回答:
 ① 温度与催化剂的催化效率和乙酸的生成速率如图。250~300℃时,温度升高而乙酸的生成速率降低的原因是____ _.
① 温度与催化剂的催化效率和乙酸的生成速率如图。250~300℃时,温度升高而乙酸的生成速率降低的原因是____ _.
② 为提高上述反应CH4的转化率,可采取的措施有
_ (写2种)。
③ Cu2Al2O4可溶解在稀硝酸中,被氧化的元素为 ,每消耗3mol Cu2Al2O4时被还原的HNO3为 mol。
(3)Li2O、Na2O、MgO均能吸收CO2,
① 若寻找吸收CO2的其他物质,下列建议合理的是___
a. 可在碱性氧化物中寻找
b. 可在具有强氧化性的物质中寻找
c. 可在ⅠA、ⅡA族元素的氧化物中寻找
② Li4SiO 4可用于吸收、释放CO2, 原理是: 500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,该原理的化学方程式_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
单晶硅是制作电子集成电路的基础材料。科学家预计,到2011年一个电脑芯片上将会集成10亿个晶体管,其功能远比我们想象的要大的多,这对硅的纯度要求很高。用化学方法可制得高纯度硅,其化学方程式为 :
①SiO2 + 2C  Si + 2CO ②Si + 2Cl2
Si + 2CO ②Si + 2Cl2 SiCl4
SiCl4
③SiCl4 + 2H2 Si + 4HCl,其中,反应①和③属于( )
Si + 4HCl,其中,反应①和③属于( )
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关气体的叙述中,不正确的是( )
A.一定温度和压强下,各种气体物质体积之比等于分子数之比
B.一定温度和压强下,各种气体物质的密度之比等于摩尔质量之比
C.一定体积和温度下,各种气体物质的物质的量之比等于压强之比
D.气体摩尔体积是指1mol任何气体所占的体积约为22.4L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com