
今有X(g)+Y(g)  2Z(g) △H<0。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,引起t2→t3曲线变化的原因是
2Z(g) △H<0。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,引起t2→t3曲线变化的原因是
| A.增大X或Y的浓度 | B.增大压强 |
| C.增大Z的浓度 | D.升高温度 |
 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:单选题
下列关于化学反应速率的说法正确的是( )
| A.根据化学反应速率的大小可以知道化学反应进行的快慢 |
| B.化学反应速率为0.8mol/(L·s)是指1s时某物质的浓度为0.8mol/L |
| C.化学反应速率是指一定时间内反应物的物质的量减少或生成物的物质的量增加 |
| D.对于任何化学反应来说,反应速率越大,反应现象就越明显 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将等质量的两份足量的锌粉a、b分别加入到等量的稀硫酸,同时向a中加少量CuSO4溶液,下图中产生H2的体积V(L)与时间t(min)的关系,其中正确的是( )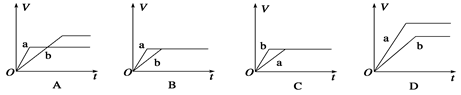
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
可逆反应A(s)+B? ?C达到平衡后,B的转化率与压强、温度的关系如图所示。下列说法正确的是( )
?C达到平衡后,B的转化率与压强、温度的关系如图所示。下列说法正确的是( )
A.B是固体,C是固体,正反应是吸热反应
B.B是气体,C是固体或液体,正反应是吸热反应
C.B是气体,C是固体或液体,正反应是放热反应
D.B、C都是气体,正反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在恒温、恒容的条件下,有反应2A(g)+2B(g) C(g)+3D(g),现从两条途径分别建立平衡。途径Ⅰ:A、B的起始浓度均为2mol/L;途径Ⅱ:C、D的起始浓度分别为2 mol/L和6mol/L。则以下叙述不正确的是
C(g)+3D(g),现从两条途径分别建立平衡。途径Ⅰ:A、B的起始浓度均为2mol/L;途径Ⅱ:C、D的起始浓度分别为2 mol/L和6mol/L。则以下叙述不正确的是
A.两途径最终达到平衡时,体系内混合气的平均相对分子质量不同
B.两途径最终达到平衡时,体系内混合气的百分组成相同
C.达平衡时,途径Ⅰ的反应速率v(A)小于途径Ⅱ的反应速率v(A)
D.达平衡时,途径Ⅰ所得混合气的密度为途径Ⅱ所得混合气密度的1/2
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各表述与示意图一致的是
A.图①表示N2O4(g) 2NO2(g) ΔH>0,N2O4转化率随温度、时间的变化 2NO2(g) ΔH>0,N2O4转化率随温度、时间的变化 |
B.图②中曲线表示反应2SO2(g)+O2(g) 2SO3(g) ΔH<0,正、逆反应的平衡常数K随温度的变化 2SO3(g) ΔH<0,正、逆反应的平衡常数K随温度的变化 |
| C.图③表示10 mL0.01 mol/LKMnO4酸性溶液与过量0.1mol/LH2C2O4溶液混合时,n(Mn2+)随时间的变化 |
| D.图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在温度、容积相同的三个密闭容器中发生反应N2(g) + 3H2(g) 2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 |
| NH3的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 体系压强 | P1 | P2 | P3 |
| 反应物转化率 | α1 | α2 | α3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
可逆反应aA(g)+bB(g) cC(g)+dD(s);△H=QkJ·mol-1,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、反应速率(v)与压强的关系如图所示。据图分析,以下说法正确的是
cC(g)+dD(s);△H=QkJ·mol-1,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、反应速率(v)与压强的关系如图所示。据图分析,以下说法正确的是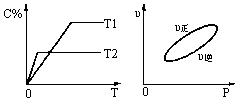
| A.T1<T2,Q>0 |
| B.增大压强,B的转化率减小 |
| C.当反应达平衡时,混合气体的密度不再变化 |
| D.a+b>c+d |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com