
A.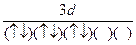 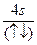 | B.(↑)(↑↓)(↑)(↑)(↑) (↑↓) |
| C.(↑↑)(↑)(↑)(↑)(↑) (↑↑) | D.(↓)(↓)(↓)(↓↑)(↓) (↑↓) |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.61 | 2.04 | 1.57 | 2.55 | 3.16 | 3.98 | 0.98 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.31 | 3.04 | 0.93 | 3.44 | 2.19 | 2.58 | 1.90 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
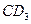 的化合物;C原子比E原子多1个电子;18gC与足量稀硫酸反应,所产生的氢气在标况下的体积为22.4L;C原子中质子数比中子数少1;D原子比A原子多一个质子。则:
的化合物;C原子比E原子多1个电子;18gC与足量稀硫酸反应,所产生的氢气在标况下的体积为22.4L;C原子中质子数比中子数少1;D原子比A原子多一个质子。则:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||||||||||
| 原子半径/10-10 m | 0.66 | 1.36 | 1.23 | 1.10 | 0.99 | 1.54 | 0.70 | 1.18 | |||||||||||
| 最高或最低化合价 | | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |||||||||||
| -2 | | | -3 | -1 | | -3 |
查看答案和解析>> 科目:高中化学 来源:不详 题型:单选题 下列说法正确的是( )
查看答案和解析>> 科目:高中化学 来源:不详 题型:填空题 (8分)现有A、B、C三种元素,已知B原子序数大于A,A与B的质子数之和为27,质子数之差为5。0.9 g C单质与足量盐酸作用放出标准状况时1.12 L氢气,同时生成C的三氯化物。完成下列问题。 (1)A是_____________,B是_____________,C是_____________。 (2)排出三种元素最高价氧化物对应水化物酸、碱性强弱顺序__________________________。 查看答案和解析>> 科目:高中化学 来源:不详 题型:单选题 某主族元素原子的第五电子层只有1个电子,其单质和化合物不可能具有的性质是( )
查看答案和解析>> 科目:高中化学 来源:不详 题型:单选题 判断下列说法中不正确的是( ) A.具有离子键的化合物一定是离子化合物 B.由一种元素的阳离子和另一种元素的阴离子构成的物质一定是纯净物 C.A、B两种单核离子所带的电性和电荷数相同,离子的核外电子层数也相同,则A、B一定为同种元素的原子 D.两种离子化合物AX3和AX2的水溶液,AX3的氧化性较AX2的强 查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |