
 →
→ ,
, →
→ ;
;

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
 二氧化硫是我国允许使用的食品漂白剂,二氧化硫的漂白作用是由于它能跟某些有色物质发生加成反应而生成不稳定的无色物质.这种无色物质容易又分解而使有色物质恢复原来的颜色.为避免食品中二氧化硫残留量超过标准要求,从而引起食用者的不良反应,漂白剂使用时要严格控制使用量及二氧化硫残留量.?
二氧化硫是我国允许使用的食品漂白剂,二氧化硫的漂白作用是由于它能跟某些有色物质发生加成反应而生成不稳定的无色物质.这种无色物质容易又分解而使有色物质恢复原来的颜色.为避免食品中二氧化硫残留量超过标准要求,从而引起食用者的不良反应,漂白剂使用时要严格控制使用量及二氧化硫残留量.?查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
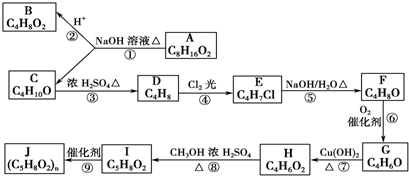
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| C | D | E |
| F |
| 编号 | 性质推测 | 化学方程式 |
| 示例 | ①:氧化性 | ①:H2FO3+4HI=F↓+2I2+3H2O |
| 1 | ②: | ③ |
| 2 | ④: | ⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 金属材料 | 溶 液 | 实验目的 |
| ① | 铝合金 | CO2+H2O | Ⅰ.探究不同溶液对金属材料的腐蚀速率; Ⅱ.探究不同金属材料的腐蚀速率; |
| ② | |||
| ③ |
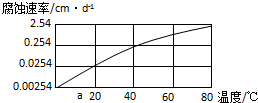
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 性质 结构 信息 | 单质在氯气中燃烧火焰呈黄色并产生大量白烟,所得产物的阳离子与E的阳离子电子数相同. | 单质是带有金属光泽的灰黑色固体,是信息技术的关键材料. | 最高价氧化物的水化物与其气态氢化物反应得到离子化合物E. | 氧化物是一种耐火材料,能溶于A的最高价氧化物的水化物得到F. |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com