
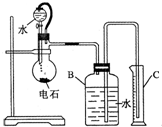
 某同学设计如图所示的实验装置来粗略测定电石中碳化钙的质量分数.
某同学设计如图所示的实验装置来粗略测定电石中碳化钙的质量分数.分析 乙炔难溶于水,用如图的实验装置来粗略地测定电石中碳化钙的质量分数,通过排水法测电石和水制取乙炔的体积测电石中碳化钙的质量分数,因电石和水反应制乙炔,所以反应前烧瓶中不能有水,所用电石质量不能太大,否则产生乙炔太多超过B的容积,无法测定,也不能太小,否则生成乙炔太少,测出体积数据小,误差大,由分液漏斗往烧瓶里滴加水的操作方法是轻轻旋开活塞,使水缓慢滴下,直到不再产生气体为止,量筒中水的体积就近似等于乙炔的体积,据此结合方程式可算出电石中的碳化钙的质量,再算出其质量分数,
(1)电石和水反应的方程式为CaC2+2H2O→Ca(OH)2+C2H2↑;装置BC是排水量气方法测定生成乙炔的体积,B贮水,C接受排出的水;烧瓶要干燥,放入电石后应塞紧橡皮塞,否则产生的乙炔逸散到大气中产生误差;
(2)若电石的质量太大,则生成C2H2太多,超过B的空间,无法测定其体积;若选择的电石的质量太小,则生成的C2H2太少,测定误差会更大.根据1molCaC2-1molC2H2,可计算产生250mLC2H2时所需电石的质量为0.71g,即需要电石的最大质量不能超过0.71g;
(3)实验室一般用饱和食盐水代替水进行实验,以获得平稳的乙炔气流.
(4)依据反应定量关系CaC2-----C2H2,计算得到乙炔的质量,计算电石中CaC2的质量分数.
解答 解:(1)电石和水反应的方程式为CaC2+2H2O→Ca(OH)2+C2H2↑;装置B用于贮水以便烧瓶中生成的C2H2气体进入B时排出与它等体积的水进入量筒C来测定生成乙炔的量;电石和水反应生成乙炔,烧瓶要干燥,放入电石后应塞紧橡皮塞,否则产生的乙炔逸散到大气中产生误差,
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;贮水以使烧瓶中产生的气体CH≡CH进入B时排出与它等体积的水,进入量筒C测定乙炔的体积;防止电石与残留的水作用,防止产生的乙炔逸散到大气中;
(2)若电石的质量太大,则生成C2H2太多,超过B的空间,无法测定其体积;若选择的电石的质量太小,则生成的C2H2太少,测定误差会更大.根据1molCaC2-1molC2H2,可计算产生250mLC2H2时所需电石的质量为0.71g,即需要电石的最大质量不能超过0.71g,结合题目信息,应选择0.60g电石进行实验;
故答案为:生成C2H2太多,超过B的空间;生成的C2H2太少,测定误差会更大;0.60;
(3)实验室一般用饱和食盐水代替水进行实验,以获得平稳的乙炔气流;
故答案为:饱和食盐水;
(4)设产生VmL气体需要CaC2的质量为mg,则
CaC2-----C2H2,
64g 22400mL
m VmL
解得m=0.0029V,则电石中CaC2的质量分数=$\frac{0.0029V}{W}$×100%=$\frac{0.29V}{W}$%;
故答案为:$\frac{0.29V}{W}$%.
点评 本题考查了物质性质的探究实验分析判断,实验数据的分析和计算,乙炔性质和制备,掌握实验基本操作和实验设计方法是解题关键,题目难度中等.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 表示乙醇燃烧热的热化学方程式(△H的绝对值正确):C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0kJ•mol-1 | |
| B. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O | |
| C. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O | |
| D. | 用硫酸酸化的橙色的重铬酸钾(K2Cr2O7)溶液与乙醇作用生成乙酸和草绿色三价铬,可以用于检测是否酒后驾驶:2Cr2O72-+3C2H5OH+16H+→4Cr3++3CH3COOH+11H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④②①③ | B. | ②④①③ | C. | ④①②③ | D. | ②④③① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2OCH3 | B. | CH3CH(OH)CH3 | C. | CH3CH2 CH2CH2OH | D. | CH3CH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LCH3COONa溶液与0.1mol/L HCl溶液等体积混合:c(Na+)>c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 0.1mol/L NH4Cl溶液与0.1mol/L氨水等体积混合(pH>7):c(NH3.H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1mol/L Na2CO3与0.1mol/LNaHCO3溶液等体积混合:2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3) | |
| D. | 0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ①H2SO4溶液中HSO4- | ②NaHSO4溶液中HSO4- | ③CH3COOH | ④HCl溶液 |
| 10% | 29% | 1.33% | 100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸生产中常采用催化剂提高SO2的转化率 | |
| B. | 合成氨中采用及时分离氨气提高反应速率 | |
| C. | 电镀铜时,溶液中c(Cu2+)基本保持不变 | |
| D. | 用电解熔融氧化镁的方法制取镁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com