
| A. | ①④ | B. | ③ | C. | ①②③ | D. | 全部 |
分析 将固体物质溶于水,再将其溶液加热,蒸发结晶、再灼烧,能得到化学组成与原固体物质相同,说明该物质较稳定,加热不分解,且不水解生成挥发性酸,据此分析解答.
解答 解:①胆矾溶于水后,将溶液蒸发结晶再灼烧得到硫酸铜而不是胆矾,所以得不到原物质,故错误;
②氯化铝溶于水后,将溶液蒸发结晶时促进氯化铝水解,氯化氢具有挥发性,所以蒸发结晶得到的固体是氢氧化铝,再灼烧氢氧化铝得到氧化铝,所以得不到原物质,故错误;
③硫酸铝溶于水后,蒸发过程中硫酸铝水解得到硫酸和氢氧化铝,但硫酸没有挥发性,所以蒸发结晶得到的固体是硫酸铝,硫酸铝较稳定,在灼烧时不分解,所以最终得到的固体是原物质,故正确;
④氯化铜溶于水后,蒸发结晶过程中氯化铜水解生成氢氧化铜和氯化氢,蒸发促进氯化氢挥发,所以蒸发结晶得到的固体是氢氧化铜,氢氧化铜不稳定,在灼烧时分解生成氧化铜,所以最终得到的固体不是原物质,故错误;
故选B.
点评 本题以盐类水解为载体考查物质的性质,只有性质稳定、水解不生成挥发性酸的盐蒸发结晶得到原来物质,水解生成挥发性酸的盐蒸发结晶灼烧时得到氧化物.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2既是氧化剂,又是还原剂 | |
| B. | 还原产物与氧化产物的物质的量之比为5:1 | |
| C. | 当转移了3 mol电子时,反应消耗了3 mol的Cl2 | |
| D. | 反应中NaOH提供了碱性环境,但它既不是氧化剂也不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 离子 | Cu2+ | Al3+ | NO3- | Cl- |
| 物质的量浓度(mol/L) | 1 | 1 | a | 1 |
| A. | 电解后溶液pH=0 | B. | a=3 | ||
| C. | 阳极生成1.5mol Cl2 | D. | 阴极析出的金属是铜与铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
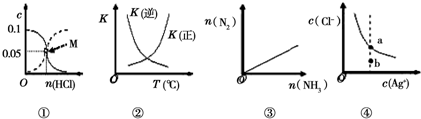
| A. | 图①表示室温下,用0.1 mol•L-1的氨水吸收HCl气体时,溶液中的粒子浓度随HCl体积的变化.实现表示c(NH3•H2O),虚线表示c(NH4+),处于M点时溶液呈中性 | |
| B. | 图②表示2SO2(g)+O2(g)?2SO3(g)△H<0,正逆反应的平衡常数随温度的变化 | |
| C. | 图③表示2NH3(g)?N2(g)+3H2(g),在恒温恒压的密闭容器中达平衡时N2的物质的量随的 NH3物质的量的变化 | |
| D. | 图④表示AgCl(s)?Ag+(aq)+Cl-(aq)的离子浓度关系,当处于b点时,蒸发部分水后,可到达平衡线的a点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{6}^{13}$C的质量数是13,原子序数是6,核内有6个中子 | |
| B. | ${\;}_{6}^{13}$C与金刚石、石墨、C60等互为同素异形体 | |
| C. | ${\;}_{6}^{13}$C与${\;}_{6}^{12}$C是两种不同的碳元素 | |
| D. | ${\;}_{6}^{13}$C是碳的一种核素,与${\;}_{6}^{12}$C互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
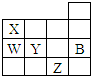
| A. | 常压下,五种元素的单质中,Z单质的沸点最高 | |
| B. | X的氢化物沸点比W的氢化物沸点高 | |
| C. | Y元素氧化物的水化物酸性比W的强 | |
| D. | Y、Z的简单阴离子的电子层结构都与B原子的相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com