
下列关于物质或离子检验的叙述正确的是
A.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+
B.气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气
C.灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+
D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源:2015-2016学年青海省高二上9月质检化学试卷(解析版) 题型:选择题
下列各组物质的燃烧热相等的是
A.碳和一氧化碳 B.1mol碳和2mol碳
C.1mol乙炔和2mol碳 D.淀粉和纤维素
查看答案和解析>>
科目:高中化学 来源:2016届广东省揭阳市高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列各组离子在指定的溶液中能大量共存的是
①无色溶液中:K+、Cu2+、Na+、SO42﹣
②pH=11的溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣
③加入Al能放出H2的溶液中:Cl﹣、HCO3﹣、NO3﹣、NH4+
④在由水电离出的c(OH﹣)=10﹣13mol•L﹣1的溶液中:Na+、Ba2+、Cl﹣、I﹣
⑤能使红色石蕊试纸变为蓝色的溶液:Na+、Cl﹣、S2﹣、ClO﹣
⑥酸性溶液中:Fe2+、Al3+、NO3﹣、Cl﹣.
A.①②⑤ B.②④ C.②④⑥ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期期中测试化学试卷(解析版) 题型:选择题
下列离子方程式不正确的是
A.Fe3O4与稀硝酸反应的离子方程式为:Fe3O4+8H+=Fe2++2Fe3++4H2O
B.用稀硫酸除去铜绿:4H++Cu2(OH)2CO3=2Cu2++CO2↑+3H2O
C.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:
2Ba2++NH4++Al3++SO42-+4OH-=Al(OH)3↓+NH3•H2O+2BaSO4↓
D.少量氢氧化钙溶液与碳酸氢钠溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期9月学情调研化学试卷(解析版) 题型:选择题
“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如何利用NaOH溶液来“捕捉”CO2,其基本过程如图所示(部分条件及物质未标出).
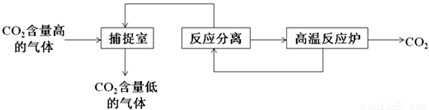
下列有关该方法的叙述中正确的是
A.能耗大是该方法的一大缺点
B.整个过程中,只有一种物质可以循环利用
C.“反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤
D.该方法可减少碳排放,捕捉到的CO2还可用来制备尿素等产品
查看答案和解析>>
科目:高中化学 来源:2016届广东省高三上学期第二次教学质检化学试卷(解析版) 题型:实验题
(15分)钢铁企业酸洗钢材时产生的废液主要成分为Fe2+、H+、Cl-,可用下述方法处理该废液,回收盐酸和制备氧化铁涂料。
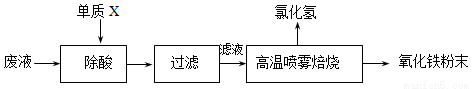
(1)单质X的化学式是 。
(2)氯化亚铁溶液经高温喷雾焙烧转化为HCl气体和氧化铁粉末,有关的化学方程式依次为: 。
(3)某铁红涂料中除含有Fe2O3外,还可能添加有CuO或FeO中的一种,请设计实验方案,探究该铁红涂料中添加物的成分。
① 提出合理假设
假设1:添加了CuO
假设2:添加了FeO
② 请设计方案,验证上述假设,写出实验步骤、预期现象和结论。
限选试剂:铁粉、3mol•L-1H2SO4、0.1 mol•L-1酸性KMnO4溶液、10%NaOH溶液、10%H2O2、KSCN溶液
操作步骤 | 预期现象和结论 |
步骤1.取少量样品于试管中, ____________________________ | 样品全部溶解,得到澄清的溶液。 |
步骤2. __________________ 步骤3. __________________ | ___________________________ ___________________________ ___________________________ ___________________________ |
(4)请计算,用635g水完全吸收“高温喷雾焙烧”产生的HCl气体 升(标准状况),即可得到36.5%的浓盐酸(相对原子质量 Cl 35.5 H 1)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二10月月考化学试卷(解析版) 题型:选择题
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知
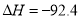 kJ·mol
kJ·mol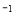 )
)
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
NH3的浓度(mol·L | c1 | c2 | c3 |
反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 |
|
|
|
下列说法正确的是
A.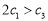 B.α1+α3=1 C.
B.α1+α3=1 C.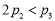 D.
D.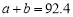
查看答案和解析>>
科目:高中化学 来源:2016届贵州省遵义市高三上学期第一次联考化学试卷(解析版) 题型:填空题
【物质结构与性质】(15分)铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材 料。回答下列问题:
(1)基态铜原子的电子排布式为 ;已知高温下CuO—→Cu2O+O2,试从铜原子价层电子结构变化角度解释这一反应发生的原因: 。
(2)硒、硅均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,分子构型分别为 ,若“Si-H”中键合电子偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为__ __。
(3)与镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3.NH3,BF3.NH3中B原子的杂化轨道类型为_______________,B与N之间形成 键。
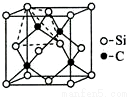
(4)金刚砂(SiC)的硬度为9.5,其晶胞结构如图所示;则金刚砂晶体类型为 ,在SiC中,每个C原子周围最近的C原子数目为 ,若晶胞的边长为a pm,则金刚砂的密度为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省黄石市高一上学期10月月考化学试卷(解析版) 题型:计算题
现有一种泉水,取0.5 L这种泉水作为样品,经测定该样品中含有48.00 mg的Mg2+。那么,该泉水中Mg2+的物质的量的浓度是多少?为使该泉水样品所含的Mg2+全部沉淀,应加入1 mol/L NaOH溶液的体积是多少?(请写出简要计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com