
【题目】能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的措施是
A. 向纯水中投入一小块金属钠B. 将水加热煮沸
C. 向水中通入SO2D. 向水中加入NaCl
【答案】C
【解析】
根据水的电离平衡:H2O![]() H++OH-,溶液中c(H+)>c(OH-),说明溶液呈酸性,再根据影响水的电离的因素:温度、同离子效应、所加物质的酸碱性等具体分析水的电离平衡的移动。
H++OH-,溶液中c(H+)>c(OH-),说明溶液呈酸性,再根据影响水的电离的因素:温度、同离子效应、所加物质的酸碱性等具体分析水的电离平衡的移动。
A、加入金属钠,和水电离出的氢离子反应生成氢氧化钠和氢气,氢离子浓度降低,使水的电离向右移动,碱性增强,c(H+)<c(OH-),选项A错误;
B、加热时促进水的电离,但是氢离子和氢氧根浓度依然相等,溶液仍然呈中性,选项B错误;
C、二氧化硫溶于水形成亚硫酸,溶液中的c(H+)>c(OH-),酸对水的电离起抑制作用,选项C正确;
D.向水中加入NaCl,对水的电离无影响,c(H+)=c(OH-),选项D错误;
答案选C。


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】中医经典方剂组合对新冠肺炎病毒治疗具有良好的效果。其中的一味中药黄芩的有效成分结构简式如图所示,下列说法错误的是
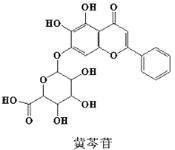
A.黄芩苷是芳香化合物,共含有四种官能团B.黄芩苷可发生取代、加成、氧化、还原反应
C.1mol 黄芩苷最多消耗 3molNaOHD.1 mol 黄芩苷最多与 7mol H2 发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质之间有如下反应关系:
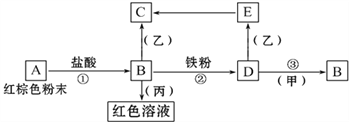
已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色。
回答:
(1) 写出下列物质的化学式:A______B______D________甲_______乙_______丙__________
(2) 写出E→C反应的化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的密闭容器中,不能说明可逆反应H2(g)+I2(g)![]() 2HI(g)已经达到平衡的标志是( )
2HI(g)已经达到平衡的标志是( )
A.HI的生成速率与HI的分解速率相等
B.HI的生成速率与H2的生成速率之比是2∶1
C.单位时间内一个H-H键断裂的同时有两个H-I键断裂
D.单位时间里断裂2nmolHI的同时生成nmolI2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铬常用于提升特种合金的性能。工业上以铬铁矿(主要成份为FeO·Cr2O3,含有少量Al2O3)为原料制备金属铬的流程如下图。下列说法不正确的是( )
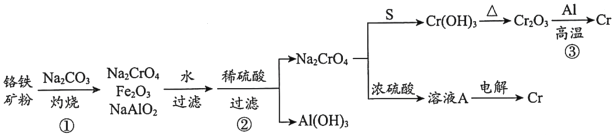
A.①中需持续吹入空气作氧化剂B.②中需加入过量稀硫酸
C.③中发生了置换反应D.溶液A为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中有如下反应:L(s)+aG(g) ![]() bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )
bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )
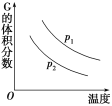
A.正反应为放热反应
B.G的转化率随温度升高而减小
C.化学方程式中的计量数a>b
D.增大压强,容器内气体质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
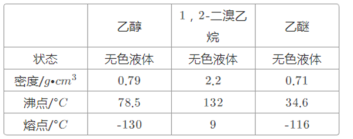
【题目】实验室制备1,2—二溴乙烷的反应原理如下:CH3CH2OH![]() CH2=CH2,CH2=CH2+Br2→CH2BrCH2Br
CH2=CH2,CH2=CH2+Br2→CH2BrCH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚;浓硫酸把乙醇氧化为CO2等。用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如图所示:
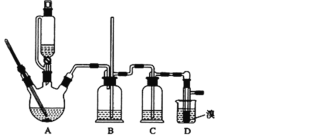
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是__。
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入__,(填序号)其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是__。
(4)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在__层(填“上”、“下”)
(5)若产物中有少量未反应的Br2,最好用___洗涤除去(填序号)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用___的方法除去。
(7)反应过程中应用冷水冷却装置D,其主要目的是__,但又不能过度冷却(如用冰水),其原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。

(1)试剂X的化学式________。A中制取Cl2的离子方程式____________________。
(2)试剂Y的名称为______________。
(3)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中除含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和____________________________;
假设2:存在三种成分:NaHCO3和__________________________。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
实验步骤 | 预期现象和结论 |
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中 | |
步骤2:向A试管中滴加BaCl2溶液 | __________________ |
步骤3:______________ | __________________ |
(4)已知Cl2O与水反应生成次氯酸,则D中Cl2O进入E反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应,得到如下表中的两组数据:已知2SO2(g)+ O2(g) ![]() 2SO3(g) △H<0
2SO3(g) △H<0
实验 编号 | 温度/℃ | 平衡常数 | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
下列说法中不正确的是( )
A. x=2.4
B. 实验1在前6 min的反应速率v(SO2)=0.2 mol·L-1·min-1
C. K1、K2的关系:K2>K1
D. T1、T2的关系:T1>T2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com