



 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
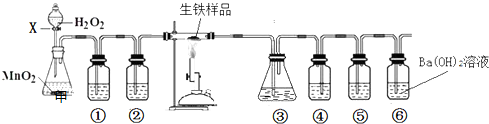
| ||
| ||
| 12w2 |
| 197w1 |
| 12w2 |
| 197w1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
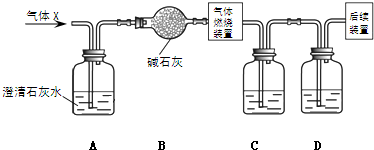
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
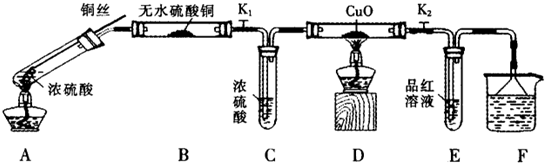
| 硫酸/mol?L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省四地六校高三上学期第三次月考化学试卷(解析版) 题型:选择题
按如图装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )

①c(Ag+) ②c(AgNO3) ③a棒的质量 ④b棒的质量 ⑤溶液的pH
A.①③ B.③④ C.①②⑤ D.①②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com