
| A. | 3-氯戊烷的分子式为C6H9Cl3 | B. | 3-氯戊烷属于烷烃 | ||
| C. | 3-氯戊烷的一溴代物共有3种 | D. | 3-氯戊烷的同分异构体共有6种 |
分析 A、3-氯戊烷是在3号碳上含有1个Cl原子的卤代烃;
B、3-氯戊烷含有卤素原子,属于烃的衍生物;
C、3-氯戊烷中含有3种环境的H原子;
D、戊烷有3种同分异构体,其中含有8种H,据此解答即可.
解答 解:A、3-氯戊烷是在3号碳上含有1个Cl原子的卤代烃,则3-氯戊烷的分子式为:C5H11Cl,故A错误;
B、含有Cl原子、H原子和C原子,属于卤代烃,故B错误;
C、3-氯戊烷中含有3种环境的H原子,所以3-氯戊烷的一溴代物共有3种,故C正确;
D、戊烷有3种同分异构体,其中含有8种H,就有8种同分异构体,故D错误,
故选C.
点评 本题主要考查的是有机物的命名、分子式书写、卤代烃的性质以及同分异构体判断等,综合性较强,侧重于基础知识的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | X的能量一定高于N | |
| B. | 断开X、Y中的化学键吸收的能量大于形成M、N中化学键放出的能量 | |
| C. | X、Y的总能量一定高于M、N的总能量 | |
| D. | 因该反应是放热反应,故不加热一定可以反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
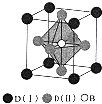 A、B、C、D是周期表中序数依次增大的前四周期元素,A的最高正价与最低负价代数和为零,常温常压下B、C的单质呈气态,A22-、B2、C22+互为等电子体,基态D3+的M层有5个能量和自旋方向均相同的电子,回答下列问题:
A、B、C、D是周期表中序数依次增大的前四周期元素,A的最高正价与最低负价代数和为零,常温常压下B、C的单质呈气态,A22-、B2、C22+互为等电子体,基态D3+的M层有5个能量和自旋方向均相同的电子,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:MgO>CaS | B. | 熔点:Li>Na | ||
| C. | 沸点:SiCl4>CF4 | D. | 沸点:邻硝基苯酚>间硝基苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有氢氧化钠 | B. | 碳酸钠和氢氧化钠 | ||
| C. | 碳酸氢钠和氢氧化钠 | D. | 只有碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 NH3•H2O+H+(用离子方程式表示);
NH3•H2O+H+(用离子方程式表示); Ca2+(aq)+CuA(s).
Ca2+(aq)+CuA(s).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
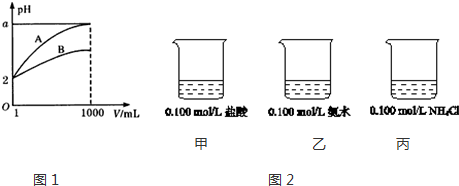
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com