
| A、3.01×1023 |
| B、2 |
| C、1.204×1024 |
| D、0.5 |
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3:1 | B、2:1 |
| C、1:1 | D、1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁和稀硝酸反应制得浅绿色溶液:Fe+4H++NO3-═Fe3++NO↑+2H2O |
| B、实验室盛碱液的瓶子不用玻璃塞:SiO2+2OH-═SiO32-+H2O |
| C、碳酸氢镁和足量的氢氧化钙溶液反应:Ca2++OH-+HCO3-═CaCO3↓+H2O |
| D、向Ca(ClO)2溶液中通入过量CO2:2ClO-+H2O+CO2═2HClO+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、还原性:X的氢化物>Y的氢化物>Z的氢化物 |
| B、简单离子的半径:M的离子>Z的离子>Y的离子>X的离子 |
| C、YX2、M2Y都是含有极性键的共价化合物 |
| D、Z元素的最高价氧化物的水化物的化学式为HZO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
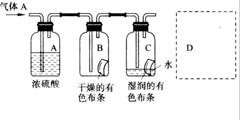 某学生用如图所示的方法研究物质的性质,其中气体A的主要成分,杂质是空气和水蒸气,回答下列问题:
某学生用如图所示的方法研究物质的性质,其中气体A的主要成分,杂质是空气和水蒸气,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com