
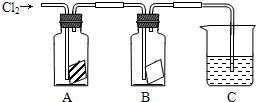
分析 氯气可与水反应生成具有漂白性的次氯酸,干燥的氯气不具有漂白性,A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,则氯气不能使A中纸条褪色,而B中生成HClO,所以纸条褪色;氯气有毒,不能排放在空气中,利用NaOH溶液吸收,以此解答该题.
解答 解:(1A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,则氯气不能使A中纸条褪色,而B中生成HClO,所以纸条褪色,则A中没有明显现象,B中褪色,因B中生成的HClO具有漂白性,反应的化学方程式为Cl2+H2O=HCl-+HClO,
故答案为:无明显现象;纸条褪色;氯气无漂白作用,氯气与水反应生成的HClO具有漂白作用;Cl2+H2O=HCl-+HClO;
(2)氯气有毒,不能排放在空气中,利用NaOH溶液吸收,所以C的作用为除去多余的Cl2气,防止污染环境,发生的反应为Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:吸收多余的氯气;NaOH溶液;Cl2+2NaOH=NaCl+NaClO+H2O.
点评 本题以氯气的性质为载体考查性质实验方案的设计,注意A、B装置的对比作用及环境保护为解答的关键,把握HClO具有漂白性即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 单质硅用于制造芯片和光导纤维 | |
| B. | 84消毒液的有效成分是NaClO | |
| C. | SO2具有漂白性,通入紫色石蕊溶液中能使溶液先变红后褪色 | |
| D. | 普通玻璃的组成可用Na2O•CaO•6SiO2表示,是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
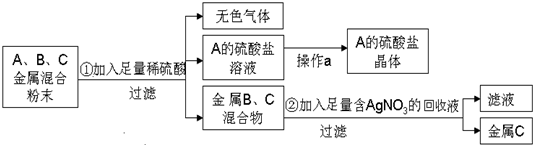
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 叠氮酸(HN3)与醋酸酸性相似,NaN3水溶液中离子浓度大小顺序为c(Na+)>c(N3-)>c(OH-)>c(H+) | |
| C. | 常温下向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-) | |
| D. | 常温下,等pH的CH3COONa、NaHCO3、NaClO三种溶液的浓度大小关系为c(NaClO)>c(NaHCO3)>c(CH3COONa) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
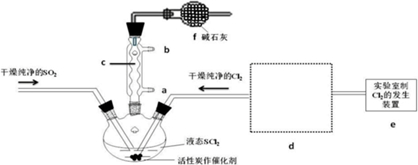
| 方案 | 甲 | 乙 | 丙 | 丁 |
| 发生装置 | 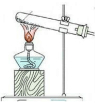 |  |  |  |
| 所选试剂 | NaHSO3固体 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO3 | 70%H2SO4+K2SO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com