
| A. | v(H2)=0.03 mol/(L•min) | B. | v(N2)=0.02 mol/(L•min) | ||
| C. | v(NH3)=0.01 mol/(L•min) | D. | v(NH3)=0.17 mol/(L•min) |
分析 根据v=$\frac{△c}{△t}$计算v(NH3),再根据速率之比等于化学计量数之比计算其它物质的反应速率.
解答 解:在一定条件下,反应N2+3H2?2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,氨气的物质的量=$\frac{1.7g}{17g/mol}$=0.1mol,故v(NH3)=$\frac{0.1mol}{2L•5min}$=0.01mol/(L.min),
A.速率之比等于化学计量数之比,故v(H2)=1.5v(NH3)=0.015mol/(L.min),故A错误;
B.速率之比等于化学计量数之比,故v(N2)=0.5v(NH3)=0.005mol/(L.min),故B错误;
C.由上述计算可知,v(NH3)=0.01mol/(L.min),故C正确;
D.由上述计算可知,v(NH3)=0.01mol/(L.min),故错误;
故选C.
点评 本题考查化学反应速率计算,比较基础,常用定义法及速率规律解答,根据情况选择合适的方法.


科目:高中化学 来源: 题型:选择题
| A. | 在含Al3+、H+的溶液中缓慢滴加NaOH溶液:Al3+、H+ | |
| B. | 在含SiO32-的溶液缓慢滴加稀盐酸:SiO32-、CO32- | |
| C. | 在含Br-、Fe2+的溶液中缓慢通入氯气:Br-、Fe2+ | |
| D. | 在含有Cu2+、Fe3+的溶液中加入锌粉:Cu2-、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
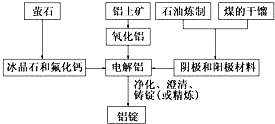 如图是传统的工业生产金属铝的基本流程图.结合铝生产的流程图回答下列问题:
如图是传统的工业生产金属铝的基本流程图.结合铝生产的流程图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 单质分子中都存在非极性键 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 乙醇分子中只存在极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
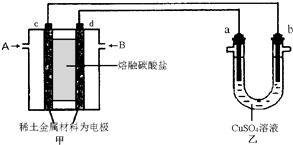
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com