

| A. | 淡化海水的方法主要有蒸馏法、电渗析法、离子交换法 | |
| B. | 以NaCl为原料可以生产烧碱、纯碱、金属钠、氯气、盐酸等化工产品 | |
| C. | 步骤Ⅱ中鼓入热空气吹出溴,是因为溴蒸气的密度比空气的密度小 | |
| D. | 用SO2水溶液吸收Br2的离子反应方程式为Br2+SO2+2H2O═4H++SO42-+2Br- |
分析 海水淡化得到氯化钠,电极氯化钠溶液或熔融状态氯化钠会生成氯气,氯气通入母液中发生反应得到低浓度的溴单质溶液,通入热空气吹出后用二氧化硫水溶液吸收得到韩HBr和的溶液,通入适量氯气氧化得到溴单质,富集溴元素,蒸馏得到工业溴,
A.根据淡化海水的方法分析,根据目前淡化海水的方法有:蒸馏法、结晶法、淡化膜法、多级闪急蒸馏法等,其中最常用的是蒸馏法;
B.电解饱和食盐水生产烧碱、氯气、氢气、盐酸,电解熔融氯化钠生产金属钠和氯气,向氨化的饱和食盐水中通入氨气生成碳酸氢钠晶体,分解得到碳酸钠;
C.溴单质是易挥发的非金属单质;
D.二氧化硫具有还原性和溴单质发生氧化还原反应生成溴化氢和硫酸.
解答 解:A.目前淡化海水的方法有多种,如:蒸留法、电渗透法、离子交换法、水合物法、溶剂萃取法和冰冻法,故A正确;
B.电解饱和食盐水生产烧碱、氯气、氢气,其中氯气和氢气可以生产盐酸,电解熔融氯化钠生产金属钠和氯气,向氨化的饱和食盐水中通入氨气生成碳酸氢钠晶体,分解得到纯碱碳酸钠,故B正确;
C.步骤Ⅱ中鼓入热空气吹出溴,是因为溴蒸气易挥发,故C错误;
D.二氧化硫和溴单质反应生成的硫酸和溴化氢都是强酸完全电离,反应的离子方程式为:Br2+SO2+2H2O═4H++SO42-+2Br-,故D正确;
故选C.
点评 本题考查海水资源的理解原理,涉及海水的淡化、海水提溴、氧化还原反应等知识,侧重于考查学生综合运用化学知识的能力,题目难度不大,注意把握氧化性、还原性的比较方法.


科目:高中化学 来源: 题型:选择题
| A. | 用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等 | |
| B. | 浓度均为0.1 mol•L-1的 HCOONa和NaCl溶液中阴离子的物质的量浓度之和:前者大于后者 | |
| C. | 0.2 mol•L-1 CH3COONa 与 0.1 mol•L-1盐酸等体积混合后的溶液 (pH<7)中,某些粒子浓度大小关系:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| D. | 0.4 mol•L-1 HCOOH 与 0.2 mol•L-1 NaOH 等体积混合后的溶液中,某些粒子浓度大小关系:c(HCOO-)+c(OH-)=c(HCOOH)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物可能含共价健 | |
| B. | 离子化合物中一定不含共价键,阳离子只能是金属离子 | |
| C. | 共价化合物可能含离子键 | |
| D. | 有化学键断裂就一定有化学键形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.9g | B. | 4.5g | C. | 9.0mol | D. | 13.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
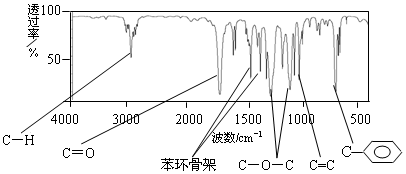
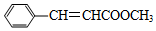 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
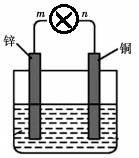 将质量均为100g的锌片和铜片用导线与灯泡串联浸入盛有500mL 2mol•L-1稀硫酸溶液的1.5L容器中构成如图装置.
将质量均为100g的锌片和铜片用导线与灯泡串联浸入盛有500mL 2mol•L-1稀硫酸溶液的1.5L容器中构成如图装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ; D物质中官能团的名称是羧基.
; D物质中官能团的名称是羧基.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 分离方法 | 原理 |
| A | 分离溶于水的碘 | 苯萃取 | 苯的密度比水小 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 除去KNO3固体中混杂的NaCl | 重结晶 | KNO3在水中的溶解度很大 |
| D | 除去纯碱中的碳酸氢铵 | 加热 | 热稳定不同 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池.
液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com