
在一定温度下,下列叙述不是可逆反应A(g)+3B(g)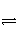
 2C(g)达平衡状态的是( )
2C(g)达平衡状态的是( )
①C生成速率与C分解速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④A、B、C的分压不再变化
⑤混合气体的总压不再变化
⑥混合气体的物质的量不再变化
⑦单位时间内消耗a mol A,同时生成3a mol B
⑧A、B、C的分子数之比为1∶3∶2
A.②⑧ B.①⑥ C.②④ D.③⑧
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
恒温(1100℃)恒容密闭容器中发生反应:
Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g)。下列说法正确的是
Na2S(s)+4H2O(g)。下列说法正确的是
A. 该反应的平衡常数表达式K=c(H2O)/c(H2)
B. 若容器内气体的密度或压强保持不变,均说明该反应已达到平衡状态
C. 若Na2SO4足量,改变起始充入H2的浓度,达平衡时H2的转化率不变
D. 若初始时投入2.84gNa2SO4与一定量H2反应达平衡时容器内固体共有2.264g,则Na2SO4的转化率为45%
查看答案和解析>>
科目:高中化学 来源: 题型:
生活中下列物质的应用或现象解释错误的是( )
A.食盐可作调味剂,也可作食品防腐剂
B.大量燃烧化石燃料是造成雾霾天气的重要因素之一
C.装饰材料释放的甲醛会造成空气污染
D.磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分NaClO)。一化学小组在室温下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO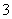 等离子其物质的量(mol)与反应时间t(min)的关系曲线。下列说法错误的是( )
等离子其物质的量(mol)与反应时间t(min)的关系曲线。下列说法错误的是( )

A.工业制取漂白液的化学反应方程式为Cl2+2NaOH===NaCl+NaClO+H2O
B.a点时溶液中各离子浓度:c(Na+)>c(Cl-)>c(ClO3-)=c(ClO-)>c(OH-)>c(H+)
C. t2~t4,ClO-离子的物质的量下降的原因可能是3ClO-= 2Cl-+ClO3-
D.使用漂白液时,为了增强漂白效果,可以向漂白液中加入浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
向某密闭容器中充入1 mol CO和2 mol H2O(g),发生反应:CO+H2O(g)
 CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
A.0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2
B.1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2
C.0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2
D.0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中加入A、B、C三种气体,在温度为T K和(T+10)K时,测得各物质的浓度如下表。据此下列结论正确的是( )
| 温度 | T K | (T+10) K | |||
| 测定时刻/s | t1 | t2 | t3 | t4 | t5 |
| c(A)/mol·L-1 | 6 | 3 | 2 | 2 | 2.2 |
| c(B)/mol·L-1 | 5 | 3.5 | 3 | 3 | 3.1 |
| c(C)/mol·L-1 | 1 | 2.5 | 3 | 3 | 2.9 |
A.在t3时刻反应已经停止
B.升高温度,该反应的化学平衡常数将增大
C.在t3时刻,若增大压强,则A的转化率将减小
D.在t2~t3内A的平均反应速率为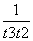 mol·L-1·s-1
mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
将不同量的H2O(g)和CO气体分别通入到一体积为1 L的恒容密闭容器中进行反应:H2O(g)+CO(g)
 CO2(g)+H2(g);得到以下三组数据,据此回答下列问题:
CO2(g)+H2(g);得到以下三组数据,据此回答下列问题:
| 实验组 | 温度 | 起始量 | 平衡量 | 达到平衡所需时间 | ||
| H2O | CO | H2 | CO | |||
| 1 | 650℃ | 1 mol | 2 mol | 0.8 mol | 1.2 mol | 5 min |
| 2 | 900℃ | 0.5 mol | 1 mol | 0.2 mol | 0.8 mol | 3 min |
| 3 | 900℃ | a | b | c | d | t |
(1)①由以上数据,实验1中以v(CO2)表示的反应速率为__________。
②该反应在650℃时平衡常数数值为__________,该反应的逆反应为________(填“吸”或“放”)热反应。
③若实验3和实验2中CO的百分含量相同,且t<3 min,则a、b应满足的关系是__________。
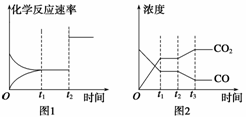
(2)下图1、2表示上述反应在时刻t1达到平衡,在时刻t2因改变某个条件而发生变化的情况:
①图1中时刻t2发生改变的条件可能是____________(写一条即可,下同)。
②图2中时刻t2发生改变的条件可能是______________________________________。
(3)在850 ℃时,其平衡常数K=1,850 ℃时在该容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2,5.0 mol H2,此时反应向________(填“正反应”或“逆反应”)方向进行,平衡时CO2的物质的量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于原子轨道的说法正确的是 ( )。
A.凡是中心原子采取sp3杂化轨道成键的分子,其几何构型都是正四面体
B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道
混合起来而形成的
C.sp3杂化轨道是由同一原子中能量最近的s轨道和p轨道混合起来形成的
一组能量相同的新轨道
D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com