
| A. | 浓硝酸光照逐渐变黄,说明光照分解生成的有色产物能溶于其中 | |
| B. | 中和滴定时,眼睛应注视滴定管中的液面下降 | |
| C. | 向饱和FeCl3溶液中滴加过量氨水,可制得Fe(OH)3胶体 | |
| D. | 配制一定物质的量浓度的溶液时,应将刚溶解后的溶液立即转移到容量瓶中 |
分析 A.浓硝酸光照分解生成二氧化氮,溶解在硝酸中;
B.中和滴定时,眼睛观察锥形瓶内颜色的变化;
C.饱和FeCl3溶液中滴加过量氨水,发生复分解反应生成沉淀;
D.溶解后,冷却至室温再转移.
解答 解:A.浓硝酸光照分解生成二氧化氮,溶解在硝酸中,则浓硝酸光照逐渐变黄,故A正确;
B.中和滴定时,眼睛观察锥形瓶内颜色的变化,判断反应的终点,不能注视滴定管中的液面下降,故B错误;
C.饱和FeCl3溶液中滴加过量氨水,发生复分解反应生成沉淀,应水解制备胶体,故C错误;
D.溶解后,冷却至室温再转移,否则浓度偏大,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、中和滴定、胶体制备、溶液配制、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 酸性HX<HY | |
| B. | 结合H+的能力Y->CO32->X->HCO3- | |
| C. | 溶液的碱性NaX>Na2CO3>NaY>NaHCO3 | |
| D. | HX和HY酸性相同,但比H2CO3弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
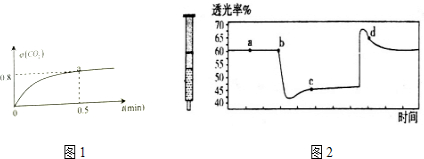
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
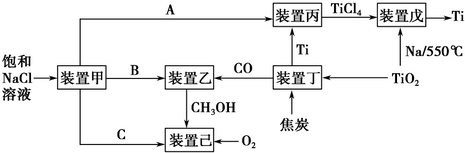
| 温度/℃ | 250 | 350 |
| K | 2.041 | x |
| c(CO)/mol•L-1 | c(H2)/mol•L-1 | c(CH3OH)/mol•L-1 | |
| 0min | 0.8mol•L-1 | 1.6mol•L-1 | 0 |
| 2min | 0.6mol•L-1 | y | 0.2mol•L-1 |
| 4min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
| 6min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
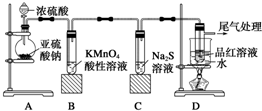
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
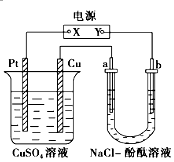 如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色.下列说法正确的是( )
如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色.下列说法正确的是( )| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com