
某课外兴趣小组探究铝与盐酸反应的反应速率与哪些因素有关。
请填写下列空白:
(1)实验化学反应原理:______________________ 。
(2)实验用品:试管(普通试管和具支试管各一支)、镊子、乳胶管、玻璃导管、水槽、;稀盐酸(4mol/L)、铝条(片)、水、胶头滴管、温度计。
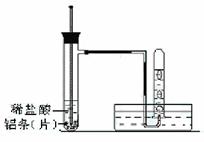
(3)实验装置 (图中铁架台等夹持仪器略去)
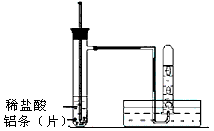
(4)实验方法
①按如上图所示连接好实验仪器,检查装置的气密性,具体操作方法是:__________________ 。
②取3块铝条(足量)加入到试管中。
③在盛有铝条的试管中,加入2mL稀盐酸。
④测量试管中溶液的温度。
⑤收集反应产生的氢气。
(5)数据处理及问题讨论
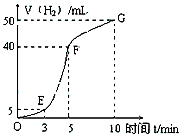
①实验结束后,课外兴趣小组成员将产生氢气的体积与时间作了如下的图。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 某课外兴趣小组为探究某种铝合金(含Mg Al)中铝含量,设计如图装置进行实验.
某课外兴趣小组为探究某种铝合金(含Mg Al)中铝含量,设计如图装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 某课外兴趣小组欲探究铝与盐酸反应的能量变化以及影响化学反应速率的因素.做如下实验,请填写下列空白:
某课外兴趣小组欲探究铝与盐酸反应的能量变化以及影响化学反应速率的因素.做如下实验,请填写下列空白:查看答案和解析>>
科目:高中化学 来源:2010-2011学年山西省吕梁市高一下学期期中考试化学试卷 题型:实验题
(10分)
某课外兴趣小组探究铝与盐酸反应的反应速率与哪些因素有关。请填写下列空白:
(1)实验化学反应原理: 。
(2)实验用品:试管(普通试管和具支试管各一支)、镊子、乳胶管、玻璃导管、水槽、;稀盐酸(4mol/L)、铝条(片)、水、胶头滴管、温度计。
(3)实验装置(图中铁架台等夹持仪器略去)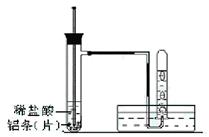
(4)实验方法
①按如图所示连接好实验仪器,检查装置的气密性
②取3块铝条(足量)加入到试管中。
③在盛有铝条的试管中,加入2mL稀盐酸。
④测量试管中溶液的温度。
⑤收集反应产生的氢气。
(5)数据处理及问题讨论
①实验结束后,课外兴趣小组成员将产生氢气的体积与时间作了如下的图。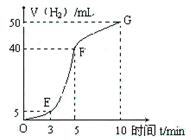
②试判断OE、EF、FG段所收集气体的多少。
OE: ;EF: ;FG: 。
写出这三段时间内产生氢气的速率大小比较(用OE、EF、FG 表示),并解释原因。
速率大小比较: 。原因:________
③如果反应太激烈,为了减缓反应速率而又不减少产生氢气
的量,他在盐酸中分别加入下列溶液:
| A.蒸馏水 | B.NaCl溶液 | C.Na2CO3溶液 | D.CuSO4溶液 E. NaNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外兴趣小组探究铝与盐酸反应的反应速率与哪些因素有关。请填写下列空白:
(1)实验化学反应原理: 。
 (2)实验用品:试管(普通试管和具支试管各一支)、镊子、乳胶管、玻璃导管、水槽、;稀盐酸(4mol/L)、铝条(片)、水、胶头滴管、温度计。
(2)实验用品:试管(普通试管和具支试管各一支)、镊子、乳胶管、玻璃导管、水槽、;稀盐酸(4mol/L)、铝条(片)、水、胶头滴管、温度计。
(3)实验装置(图中铁架台等夹持仪器略去)
(4)实验方法
①按如图所示连接好实验仪器,检查装置的气密性
②取3块铝条(足量)加入到试管中。
③在盛有铝条的试管中,加入2mL稀盐酸。
④测量试管中溶液的温度。 ⑤收集反应产生的氢气。
(5)数据处理及问题讨论
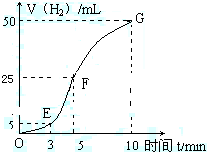
①实验结束后,课外兴趣小组成员将产生氢气的体积与时间
作了如下的图。
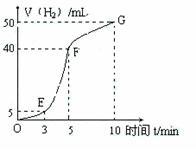 ②试判断OE、EF、FG段所收集气体的多少。
②试判断OE、EF、FG段所收集气体的多少。
OE: ;EF: ;FG: 。
写出这三段时间内产生氢气的速率大小比较(用OE、EF、FG
表示),并解释原因。
速率大小比较: 。原因:________
③如果反应太激烈,为了减缓反应速率而又不减少产生氢气
的量,他在盐酸中分别加入下列溶液:
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液 E. NaNO3溶液
你认为可行的是(填编号) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com