
| A. | 3:1:4 | B. | 2:1:1 | C. | 1:1:1 | D. | 1:2:2 |
科目:高中化学 来源: 题型:选择题
| A. | 水陆两用公共汽车中,用于密封的橡胶材料是高分子化合物 | |
| B. | 下雪后,常用播撒NaCl颗粒方法来防止道路结冰 | |
| C. | 用活性炭为糖浆脱色和用SO2漂白纸浆的原理不同 | |
| D. | 在医学上用BaSO4做钡餐,是因为Ba2+对人体无毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X:2s22p1 Y:2s22p4 | B. | X:3s23p1 Y:3s23p5 | ||
| C. | X:3s23p2 Y:2s22p3 | D. | X:3s2 Y:2s22p3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯及其化合物在生产、生活中有广泛的用途.回答下列问题:
氯及其化合物在生产、生活中有广泛的用途.回答下列问题:| 容器编号 | 温度/ | 容器体积/L | ClO2(g)的平衡转化率 |
| a | T1 | V1=1L | 75% |
| b | T2 | V2 | |
| c | T3 | V3 | 75% |
| d | |||
| e |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
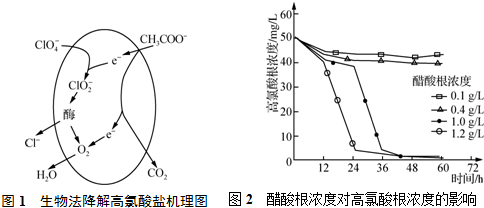
| 酸 | HClO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 1.6×10-9 | 4.2×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com