


科目:高中化学 来源: 题型:
| A、肯定有Na+、Mg2+、Al3+、Cl- | B、肯定有Al3+、SO42-、NH4+ | C、肯定没有K+、HCO3-、MnO4- | D、肯定没有K+、NH4+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
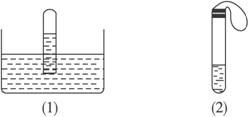
(2)在大试管中注入20 mL SO2的水溶液,滴加几滴石蕊试剂,然后套上一个气球,如图(2)所示。加热试管中的溶液一段时间后,再冷却溶液,该过程产生的现象是___________________________________________________。
(3)在大试管中注入某无色溶液,然后套上一个气球,如图(2)所示。加热大试管,溶液由无色变为红色,冷却后恢复无色,则此溶液可能是_______________溶液。加热过程中,试管中的溶液由无色变为红色的原因是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)将一支装满SO2的试管倒立在水槽中,观察到试管中的水面上升,如图(1)所示。此现象说明_______________________________________________。水没有充满试管的原因是_________________________________________________________________。
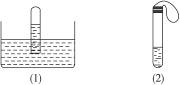
(2)在大试管中注入20 mL SO2的水溶液,滴加几滴石蕊试剂,然后套上一个气球,如图(2)所示。加热试管中的溶液一段时间后,再冷却溶液,该过程产生的现象是___________________________________________________。
(3)在大试管中注入某无色溶液,然后套上一个气球,如图(2)所示。加热大试管,溶液由无色变为红色,冷却后恢复无色,则此溶液可能是_______________溶液。加热过程中,试管中的溶液由无色变为红色的原因是___________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省金丽衢十二校高三第二次联考理综化学试卷(解析版) 题型:选择题
某无色溶液中只可能溶有NH4+、K+、Al3+、Mg2+、HCO3-、Cl-、I-、MnO4-、SO42-等离子中的几种离子。分析其组成,现进行如下实验:
①取l0mL该溶液于试管中滴加足量的Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲。
②取上述反应后的滤液,加入AgNO3溶液未见沉淀产生。
③另取l0mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加人NaOH的物质的量为0. 03 mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,体积换算成标况下为0. 224L(假设丙全部逸出),最后沉淀完全溶解。下列推断正确的是
A.肯定有K+、Al3+、Mg2+、SO42-
B.肯定有K+、NH4+、Al3+、SO42-
C.肯定没有K+、HCO3-、MnO4-
D.肯定没有K+、NH4+、Cl-
查看答案和解析>>
科目:高中化学 来源:2014届河北省高三调研考试理综化学试卷(解析版) 题型:填空题
周期表中前36号元素A、B、C、D、E、F、G、H,它们的原子序数依次增大,其中B、C、D为同一周期;E、F、G为同一周期;A和E、D和G分别为同一主族;A与B组成的化合物是一种温室气体;D元素原子的最外层电子数是次外层电子数的3倍;E是所在周期原子半径最大的元素(除稀有气体外);F元素的离子半径是同周期元素形成的简单离子中最小的;H元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。
(1)E2D2物质中化学键的类型是__________________
(2)一定条件下,A2气体与C2气体充分反应可生成6.8 g的气体,放出18.44 kJ热量,则该反应的热化学方程式为:______________________________________________________;生成物分子的空间构型为_________________,其中C的杂化方式为_______________。
(3)C和E组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是 。
(4)H的基态原子的电子排布式为__________________________已知H2+能与(2)中的生成物的水溶液形成配合物,请写出该配合物中阳离子的结构简式:_________________,在此配合物的水溶液中加入乙醇,现象是_______________________________________。
(5)某无色溶液可能存在如下离子:Ag+、Ba2+和由上推出的元素组成的离子E+、F3+、FD2―、G2―、BD32―、GD32―、GD42―,现取该溶液进行有关实验,结果如下图所示。

①生成淡黄色沉淀的离子方程式为 。
②由溶液甲生成沉淀乙的离子方程式 。
③综合上述信息,可以肯定存在的离子有 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com