
 Na2CO3和NaHCO3是两种常见的钠盐.
Na2CO3和NaHCO3是两种常见的钠盐.分析 (1)含钠元素,焰色反应为元素的性质;
(2)等物质的量的Na2CO3和NaHCO3含C的物质的量相同,则生成二氧化碳相同;
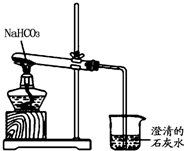
(3)进行NaHCO3的受热分解实验,发生2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑、CO2+Ca(OH)2═CaCO3↓+H2O,实验结束时先撤导管后撤酒精灯,可防止烧杯中水倒吸;
(4)碳酸氢钠加热易分解生成碳酸钠;
(5)结合2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑及差量法计算.
解答 解:(1)用洁净的铂丝蘸取Na2CO3溶液置于酒精灯火焰上灼烧,发生焰色反应,火焰呈黄色,故答案为:黄;
(2)盐酸 足量,等物质的量的Na2CO3和NaHCO3含C的物质的量相同,且均完全反应,则在相同条件下产生CO2的体积一样多,故答案为:一样多;
(3)①碳酸氢钠加热分解生成二氧化碳,烧杯中二氧化碳与石灰水反应生成碳酸钙沉淀,则烧杯中观察到溶液变浑浊,故答案为:溶液变浑浊;
②实验结束时的正确操作是先将导管从液体中移出,再熄灭酒精灯,可防止水倒吸导致大试管炸裂,故答案为:A;
(4)碳酸氢钠加热易分解生成碳酸钠,则可用加热方法出去除去碳酸钠固体中混有的碳酸氢钠,其反应的化学方程式是2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
故答案为:加热;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(5)加热10.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了2.48g,设碳酸氢钠的质量为x,则
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑△m
168 62
x 2.48g,
x=$\frac{168×2.48g}{62}$=6.72g,
则原混合物中碳酸钠的质量为10.00g-6.72g=3.28g,
故答案为:3.28.
点评 本题考查物质的性质实验,为高频考点,把握实验装置的作用、物质的性质为解答的关键,侧重分析与实验能力的考查,注重元素化合物知识与实验的结合,题目难度不大.


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 100 mL | B. | 500 mL | C. | 1 000 mL | D. | 1 500 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA | |
| B. | 50mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 相同质量的N2和CO所含有的分子数、原子总数、电子总数都相等 | |
| D. | 1 mol CH5+中含有的电子数目为11NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳与超临界水作用生成汽油的反应,属于放热反应 | |
| B. | “水热反应”是一种复杂的物理化学变化 | |
| C. | 火力发电厂可以利用废热,将二氧化碳转变为能源物质 | |
| D. | 随着科技的进步,“水热反应”制取能源有望实现地球上碳资源的和谐循环 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/溶解度/盐 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油、煤、天然气都属于化石燃料 | |
| B. | 自发反应一定是熵增大,非自发反应一定是熵减小 | |
| C. | “冰,水为之,而寒于水”说明相同质量的水和冰,冰的能量高 | |
| D. | SiO2既能溶于NaOH溶液又能溶于HF溶液,说明SiO2是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗盐(含SO42-、Ca2+等)提纯只涉及物理变化 | |
| B. | 电解饱和食盐水可制得金属钠 | |
| C. | 海水提溴涉及到氧化还原反应 | |
| D. | 海带提碘只涉及物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由6molCuFeS2生成6molCu,共消耗16.5molO2 | |
| B. | 该冶炼方法中产生大量的有害气体SO2,可回收用于制取硫酸 | |
| C. | 在反应③中,Cu2S既是氧化剂,又是还原剂 | |
| D. | 在反应①中,SO2既是氧化产物,又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl、HBr、HI的熔、沸点依次升高与分子间作用力大小有关 | |
| B. | H2O的熔、沸点高于H2S是由于H2O分子之间存在氢键 | |
| C. | I2易溶于CCl4可以用相似相溶原理解释 | |
| D. | 甲烷可与水形成氢键这种化学键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com