
【题目】已知100℃时,水的离子积常数Kw=1×10-12,对于该温度下pH=l1的氨水,下列叙述正确的是
A. 向该溶液中加入同温同体积pH=1的盐酸,反应后溶液呈中性
B. 温度降低至25℃,该氨水溶液中H2O电离出的H+浓度小于10-11mol/L
C. 该氨水溶液中加入NH4Cl溶液,NH3·H2O的电离能力增强
D. 滴加等浓度等体积的硫酸,得到的溶液中存在电离平衡:NH4HSO4(aq)![]() NH4+(aq)+H+(aq)+SO42-(aq)
NH4+(aq)+H+(aq)+SO42-(aq)
【答案】B
【解析】已知100℃时,水的离子积常数Kw=1×10-12,对于该温度下pH=l1的氨水,c(H+)=10-11mol/L,c(OH-)= =0.1mol/L,氨水是弱碱不完全电离,物质的量浓度大于0.1mol/L。A. 向该溶液中加入同温同体积pH=1的盐酸,氨水过量,反应后溶液呈碱性,选项A错误;B. 100℃时,pH=l1的氨水中H2O电离出的H+浓度等于10-11mol/L,温度降低至25℃,氨水的电离程度减小,氢氧根离子浓度减小,抑制水的电离程度减小,则该氨水溶液中H2O电离出的H+浓度小于10-11mol/L,选项B正确;C. 该氨水溶液中加入NH4Cl溶液,铵根离子浓度增大,电离平衡逆向移动,NH3·H2O的电离能力减弱,选项C错误;D. 硫酸铵是强酸的酸式盐,是强电解质,其电离方程式为:NH4HSO4=NH4+ +H++SO42-,选项D错误。答案选B。
=0.1mol/L,氨水是弱碱不完全电离,物质的量浓度大于0.1mol/L。A. 向该溶液中加入同温同体积pH=1的盐酸,氨水过量,反应后溶液呈碱性,选项A错误;B. 100℃时,pH=l1的氨水中H2O电离出的H+浓度等于10-11mol/L,温度降低至25℃,氨水的电离程度减小,氢氧根离子浓度减小,抑制水的电离程度减小,则该氨水溶液中H2O电离出的H+浓度小于10-11mol/L,选项B正确;C. 该氨水溶液中加入NH4Cl溶液,铵根离子浓度增大,电离平衡逆向移动,NH3·H2O的电离能力减弱,选项C错误;D. 硫酸铵是强酸的酸式盐,是强电解质,其电离方程式为:NH4HSO4=NH4+ +H++SO42-,选项D错误。答案选B。


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子半径依次增大,且X、Y原子序数之和是W、Z原子序数之和的2 倍,m、n、p、r是由这些元素组成的元化合物,甲、乙是其中两种元素对应的单质,n 与乙均是淡黄色固体。上述物质的转化关系如图所示(部分反应物或生成物省略)。下列说法错误的是

A. 热稳定性: p<r
B. X 与Y组成的化合物一定有漂白性
C. 含Y 元素的盐溶液可能显酸性、中性或碱性
D. Z 与W、X、Y 可形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用题图1装置(夹持装置略)收集某葡萄酒中SO2 , 并对含量进行测定. 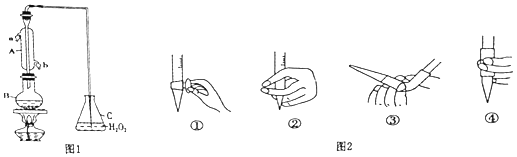
(1)仪器A的名称是 .
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为 .
(3)除去C中过量的H2O2 , 然后用0.0900mol/LNaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的 .
(4)若滴定终点时溶液的pH=8.8,则选择的指示剂为 .
(5)该测定结果往往比实际值偏高,分析是由于采用试剂不当引起的,可能的原因为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以天然气为原料合成甲醇,有关热化学方程式如下:
①2CH4(g)+O2(g)==2CO(g)+4H2(g) △H1=-70.8kJmol-1
②CO(g)+2H2(g)![]() CH3OH(g) △H2
CH3OH(g) △H2
③2CH4(g)+O2(g)![]() 2CH3OH(g) △H3=-251.0 kJmol-1
2CH3OH(g) △H3=-251.0 kJmol-1
(1)反应②的△H2=________kJmol-1;
(2)在体积可变的密闭在器中投入1 mol CO和2 mol H2,在不同条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强变化如图1所示。
CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强变化如图1所示。

①M 点时,H2 的转化率为_________;压强: p1_______(填“>”“<”或“=”)p2;
②反应速率:N 点v正(CO) _______(填“>”“<”或“=”)M 点v 逆(CO)
③若压强为p1、在1L恒容密闭容器中进行上述反应(起始投料不变),在不同温度下上述反应的平衡常数的对数(IgK)如图2所示。则温度为506K时,平衡常数K=____________, B、C、D、E四点中能正确表示该反应的1gK 与T的关系的点为________________。
④若在2L恒容密闭容器中充入x (x>0)mol H2、2 mol CO、和8 mol CH3OH(g),在 506 K下进行上述反应。为了使该反应逆向进行,x的范围为________________。
(3)某甲醇-空气燃料电池以KOH溶液为电解质溶液。当KOH全部转化成KHCO3时停止放电,写出此时负极的电极反应式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.被誉为改变未来世界的十大新科技之一的燃料电池。 右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.

试回答下列问题:
(1)燃料电池的优点是________;电解质溶液中的OH-移向______极(填“负”或“正”).
(2)写出氢氧燃料电池工作时正极反应式:_______________________。
(3)若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为___________.
(4)利用该装置可以处理氮的氧化物和NH3 尾气,总反应为:6NO2 +8NH3=7N2+12H2O,负极反应式为__________。
II.将锌片和银片浸入稀硫酸中组成原电池,若该电池中两电极的总质量为80 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为41g,试计算:
(1)产生氢气的体积(标准状况)为________________;
(2)通过导线的电子数为__________(用NA表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结论不正确的是( )
实验操作 | 现象 | 结论 | |
A | 将碘酒滴到土豆片上 | 土豆片变蓝 | 淀粉遇碘元素变蓝 |
B | 将乙醇与酸性重铬酸钾溶液混合 | 橙色溶液变为绿色 | 乙醇具有还原性 |
C | 将新制的氢氧化铜与葡萄糖溶液混合加热 | 产生砖红色沉淀 | 葡萄糖具有还原性 |
D | 将石蜡油加强热产生的气体通入溴的四氯化碳溶液中 | 溶液褪色 | 产物不都是烷烃 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是几种常见的化学电源示意图,有关说法不正确的是( ) 
A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒被破坏
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.铅蓄电池工作过程中,每通过 2 mol 电子,负极质量减轻 207 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中,a、b、c、d、e 为元素周期表中前四周期的一部分元素,下列有关叙述正确的是( )

A. 元素 b 位于ⅥA 族,有+6、-2 两种常见化合价
B. 五种元素中,元素 e 的性质最稳定
C. 原子半径有 d>c>b
D. 元素 e 参与形成的化合物可以作为一种半导体材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com