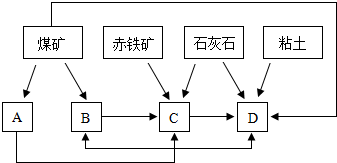
��ҵ����������ʱ�����ô�������Ӧ��SO
2ת��ΪSO
3��һ���ؼ����裮
��1��ij�¶��£�SO
2��g��+
O
2��g��?SO
3��g����H=-98kJ/mol����ʼʱ��100L���ܱ������м���4.0molSO
2��g����10.0molO
2��g��������Ӧ�ﵽƽ��״̬ʱ���ų�����196kJ������¶��µ�ƽ�ⳣ��K=
������Ӧ�¶ȱ��ֲ���ʱ��ѡ����ʵĴ������Ƿ�������SO
2��ת���ʣ�
��
��
����ǡ�����ͬ�����Ƿ��������÷�Ӧ���ų���������
��
��
��
��2����һ�������£���һ���л������ܱ������г���2molSO
2��g����1molO
2��g����������Ӧ��2SO
2��g��+O
2��g��?2SO
3��g�����ﵽƽ���ı�����������SO
2��O
2��SO
3��ƽ��Ũ�ȶ��������
A
A
������ţ���
A�������¶Ⱥ�����������䣬����2molSO
3 B�������¶Ⱥ�����������䣬����2molN
2 C�������¶Ⱥ�������ѹǿ���䣬����0.5molSO
2��0.25molO
2D�������¶Ⱥ�������ѹǿ���䣬����1molSO
3 E�������¶Ⱥ�������ѹǿ���䣬����2molN
2 F�������¶�
��3��ѹǿ���¶ȶ�SO
2ת���ʵ�Ӱ���������ʾ��
 |
0.1 |
0.5 |
1.0 |
10 |
| 400 |
99.2% |
99.6% |
99.7% |
99.9% |
| 500 |
93.5% |
96.9% |
97.8% |
99.3% |
| 600 |
73.7% |
85.8% |
89.5% |
96.4% |
��֪400�桢0.1MPa�����´ﵽƽ��ʱ��ƽ�ⳣ��ΪK
1��400�桢10MPa�����´ﵽƽ��ʱ��ƽ�ⳣ��ΪK
2��500�桢1.0MPa�����´ﵽƽ��ʱ��ƽ�ⳣ��ΪK
3��600�桢0.5MPa�����´ﵽƽ��ʱ��ƽ�ⳣ��ΪK
4����K
1��K
2��K
3��K
4�Ĵ�С˳��Ϊ
K1=K2��K3��K4
K1=K2��K3��K4
��
���ϱ����ݿ�֪�����Ṥҵ��SO
2��������Ӧ�ĺ����¶Ⱥ�ѹǿ��
1.0MPa��400�桫500��
1.0MPa��400�桫500��
��




 �żӾ���ϵ�д�
�żӾ���ϵ�д�