
【题目】某有机化合物A的结构简式如下:

(1)A的分子式是________。
(2)A在NaOH溶液中充分加热后,再加入过量的盐酸酸化后,可得到B、C、D和![]() 四种有机物,且相对分子质量大小关系为B>C>D,则B、C、D的结构简式分别是B________;C________;D________。
四种有机物,且相对分子质量大小关系为B>C>D,则B、C、D的结构简式分别是B________;C________;D________。
(3)在B的同分异构体中,属于1,3,5三取代苯的化合物的结构简式__________________。
(4)写出B与碳酸氢钠反应的化学方程式:________________________________________。
【答案】 C18H17O5N ![]() CH3CH2COOH CH3COOH
CH3CH2COOH CH3COOH 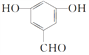
![]()
【解析】(1)该有机物中含有18个C、17个H、5个O、1个N,则分子式为C18H17O5N,故答案为:C18H17O5N;
(2)A含有-COO-和-NH-CO-,在碱性条件下可水解,再加盐酸,生成羧酸和醇、氨基酸,则得到的产物分别是解CH3COOH、CH3CH2COOH、![]() 、
、![]() ;由于相对分子质量大小关系为B>C>D,则B为:
;由于相对分子质量大小关系为B>C>D,则B为:![]() ,C为CH3CH2COOH,D为CH3COOH;故答案为:
,C为CH3CH2COOH,D为CH3COOH;故答案为:![]() ;CH3CH2COOH;CH3COOH;
;CH3CH2COOH;CH3COOH;
(3)![]() 的同分异构体中含有三个官能团,则官能团为-OH、-CHO、-OH,则属于1,3,5三取代苯的化合物的结构简式为
的同分异构体中含有三个官能团,则官能团为-OH、-CHO、-OH,则属于1,3,5三取代苯的化合物的结构简式为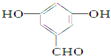 ,故答案为:
,故答案为: ;
;
(4)![]() 中的羧基能与碳酸氢钠反应生成羧基钠和二氧化碳,其反应的方程式为:
中的羧基能与碳酸氢钠反应生成羧基钠和二氧化碳,其反应的方程式为:![]() ;故答案为:
;故答案为:![]() 。
。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液态烃,0.1 mol该烃在足量的氧气中完全燃烧,生成0.6 mol CO2和0.3 molH2O;回答下列问题:
(1)A的电子式________,B的结构简式________。
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式:_______,反应类型:______________。
(3)在碘水中加入B物质的现象:________________________。
(4)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式:__________,反应类型:______________。
(5)等质量的A、B完全燃烧时消耗O2的物质的量__(填“A>B”、“A<B”或“A=B”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0.1 mol CH3COONa固体,则溶液中![]() _________(填“增大”“不变”或“减小”);写出该混合溶液中所有离子浓度之间存在的一个等式:__________________________________________。
_________(填“增大”“不变”或“减小”);写出该混合溶液中所有离子浓度之间存在的一个等式:__________________________________________。
(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可高达10.5,试用离子方程式解释土壤呈碱性的原因:________________。加入石膏(CaSO4·2H2O)可以使土壤碱性降低,有关反应的化学方程式为______________________。
(3)常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入40 mL 0.1 mol·L-1 HCl溶液,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。回答下列问题:

①在同一溶液中,H2CO3、HCO3-、CO32-____(填“能”或“不能”)大量共存。
②当pH=7时,溶液中含碳元素的主要微粒为____________,溶液中各种离子的物质的量浓度的大小关系为____________。
③已知在25 ℃时,CO32-水解反应的平衡常数即水解常数Kh=![]() =2.0×10-4,当溶液中c(HCO3-)∶c(CO32-)=2∶1时,溶液的pH=____。
=2.0×10-4,当溶液中c(HCO3-)∶c(CO32-)=2∶1时,溶液的pH=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.25 g·mL-1,质量分数36.5%的浓盐酸配制 0.1 mol·L-1的盐酸240 mL,请回答下列问题:
(1)浓盐酸的物质的量浓度为________。
(2)配制240 mL 0.1 mol·L-1的盐酸应选用________mL的容量瓶,需要浓盐酸体积为_____mL。
(3)下列操作对所配溶液的浓度大小有何影响 (填“偏大”、“偏小”或“无影响”)。
①定容时,俯视刻度线,浓度 ____________ ;
②容量瓶未干燥,浓度 __________ ;
③定容摇匀后发现溶液凹面低于刻度线,加水至刻度线,浓度 ____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人若长期食用“镉大米”(镉含量超标)会引起痛痛病。研究表明水稻对镉的吸收率与土壤的pH有紧密关系(如图所示),下列物质中可用于改良土壤结构,降低水稻对镉吸收率的是( )

A. 氯化钾 B. 烧碱 C. 熟石灰 D. 硫酸亚铁(水溶液显性)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯贝特( )是临床上一种降脂抗血栓药物,它的一条合成路线如下:
)是临床上一种降脂抗血栓药物,它的一条合成路线如下:

提示:Ⅰ.图中部分反应条件及部分反应物、生成物已略去。
Ⅱ.
Ⅲ.![]()
⑴氯贝特的分子式为 。
⑵若8.8 g A与足量NaHCO3溶液反应生成2.24 L CO2(标准状况),且B的核磁共振氢谱有两个峰,则A的结构简式为 。(相对原子质量:H-1、C-12、O-16)
⑶要实现反应①所示的转化,加入下列物质不能达到目的的是 (填选项字母)。
a.Na b.NaOH c.NaHCO3 d.CH3COONa
⑷反应②的反应类型为 ,其产物甲有多种同分异构体,同时满足以下条件的所有甲的同分异构体有 种(不考虑立体异构)。
① 1,3,5-三取代苯;
② 属于酯类且既能与FeCl3溶液显紫色,又能发生银镜反应;
③ 1 mol该同分异构体最多能与3 mol NaOH反应。
⑸写出B与足量NaOH溶液反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是

A. ①中溶液橙色加深,③中溶液变黄
B. ②中Cr2O72-被C2H5OH还原
C. 对比②和④可知K2Cr2O7酸性溶液氧化性强
D. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳捕捉技术即是二氧化碳的捕集、利用与封存(CCUS),是实现温室气体减排的重要途径之一,更是我国能源领域的一个重要战略方向,CCUS或许发展成一项重要的新兴产业。
I.利用CO2加氢合成低碳烯烃技术就是重要的应用之一。以合成C2H4为例,其合成反应为:6H2(g)+2CO2(g) ![]() CH2=CH2(g)+4H2O(g) ΔH1 ;已知H2的燃烧热为△H2;CH2=CH2(g)的燃烧热为△H3;H2O(l)= H2O(g)的热效应为△H4。
CH2=CH2(g)+4H2O(g) ΔH1 ;已知H2的燃烧热为△H2;CH2=CH2(g)的燃烧热为△H3;H2O(l)= H2O(g)的热效应为△H4。
(1)ΔH1=__________________(请用△H2、△H3、△H4表示),若将1mol CO2与3mol H2充入10L的恒容密闭容器中,达到平衡后,平衡浓度、CO2转化率与温度的关系分别如图1和图2所示,请回答下列问题:


(2)图1中曲线c代表物质的电子式___________________。
(3)该反应在较低温度时能自发进行,请分析其原因:______________________________。
(4)结合图1和图2,下列说法一定正确的是 __________。
A.其他条件不变,T1℃、增大压强,再次达到平衡时c(H2)比A点的c(H2)大
B.平衡常数:KM>KN
C.生成乙烯的速率:v(M)小于v(N)
(5)计算图2中M点时,乙烯的体积分数________________。(保留二位有效数字)
II.利用电解法也可将CO2制得乙烯,如图3所示,电极b是太阳能电池的________极,
电解时其中a极对应电解槽上生成乙烯的电极反应式为______________________________。
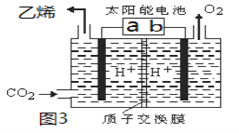
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CO2转化为甲醇的原理为 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0。500℃时,在体积为1L的固定容积的密闭容器中充入lmolCO2、3molH2,测得CO2浓度与CH3OH浓度随时间的变化如图所示,下列结论错误的是( )
CH3OH(g)+H2O(g) △H<0。500℃时,在体积为1L的固定容积的密闭容器中充入lmolCO2、3molH2,测得CO2浓度与CH3OH浓度随时间的变化如图所示,下列结论错误的是( )

A. 曲线X可以表示CH3OH(g)或H2O(g)的浓度变化
B. 从反应开始到l0min时,H2的反应速率v(H2)=0.225 mol/(L·min)
C. 平衡时H2的转化率为75%
D. 500℃时该反应的平衡常数K=3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com