
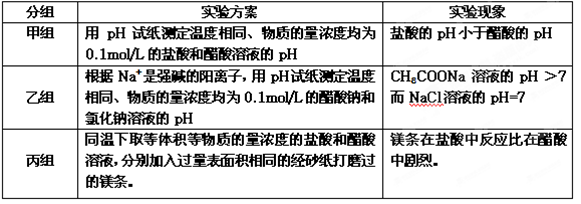
 不相等”)。
不相等”)。科目:高中化学 来源:不详 题型:单选题
| A.加入适量的氯化铵晶体后,两溶液的pH均碱小 |
| B.温度下降10oC,两溶液的pH均不变 |
| C.分别加水稀释10倍,两溶液的pH仍相等 |
| D.用盐酸中和,消耗的盐酸体积相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 NH4+ +OH-的平衡,如果使平衡向逆反应方向移动,同时使c(OH-)增大,应加入 ( )
NH4+ +OH-的平衡,如果使平衡向逆反应方向移动,同时使c(OH-)增大,应加入 ( ) | A.氯化铵固体 | B.硫酸 | C.NaOH固体 | D.大量水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.硼酸加入水中抑制水的电离 | B.硼酸是三元酸 |
| C.硼酸与强碱在溶液中反应:H3BO3+OH-→ [B(OH)4]- | D.硼酸是两性化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 K2HPO4溶液中水解
K2HPO4溶液中水解 程度大于电离程度,对于平衡HPO42-+H2O
程度大于电离程度,对于平衡HPO42-+H2O 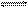 H
H 3O++PO43-,欲使溶液中c(HPO42-)、c(PO43-)、c(H3O+)三种离子浓度均减少,可采用的方法是( )
3O++PO43-,欲使溶液中c(HPO42-)、c(PO43-)、c(H3O+)三种离子浓度均减少,可采用的方法是( )| A.加水 | B.加热 | C.加消石灰 | D.加AgNO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.②④ | C.③④ | D.②③[ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.某电解质溶于水后,其导电能力不强,则此电解质必定是弱电解质 |
B.SO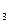 溶于水后,所得溶液导电性很好,故SO 溶于水后,所得溶液导电性很好,故SO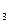 是强电解质 是强电解质 |
| C.共价化合物都是弱电解质 |
| D.弱电解质溶液中,同时存在着电解质电离出来的离子及未电离的分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com