
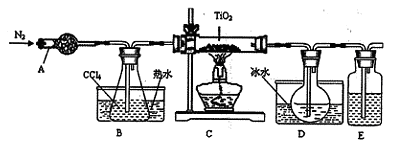
| 物质 | 熔点/℃ | 沸点/℃ | 其它 |
| CCl4 | -23 | 76 | 与 TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
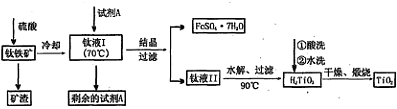
|
 Fe2O3+3H2O 。分解产生的Fe2O3混在TiO2使物质发黄。 考点:
Fe2O3+3H2O 。分解产生的Fe2O3混在TiO2使物质发黄。 考点:

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源:不详 题型:填空题
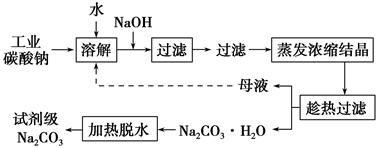
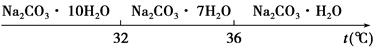
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
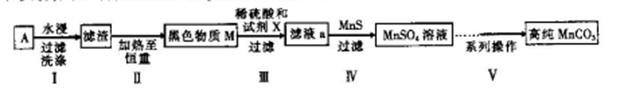

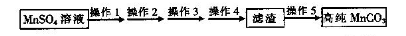
 已除干净; 操作4:___________________;
已除干净; 操作4:___________________; 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题


| A.从KI和I2的固体混合物中回收I2,可使用如图甲所示实验装置 |
| B.分离Na2CO3溶液和CH3COOC2H5,可使用如图乙所示实验装置 |
| C.实验室制氨气,如图丙所示 |
| D.分离乙醇和乙酸的混合液,实验装置如图丁所示 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验现象 | 结 论 |
| A | 将少量Fe(NO3)2试样加水溶解,滴加稀H2SO4酸化,再滴加KSCN溶液 | 溶液变成红色 | Fe(NO3)2试样已变质 |
| B | 将少量某无色气体通入澄清石灰水 | 出现白色沉淀 | 该气体一定是CO2 |
| C | 分别测定常温下0.1 mol·L-1 Na2SiO3溶液和Na2CO3溶液的pH | pH: Na2SiO3 >Na2CO3 | 非金属性: Si>C |
| D | 向浓度均为0.1 mol·L-1 NaCl和NaI混合溶液中,滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl) >Ksp(AgI) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 混合物 | 加入试剂或方法 | 反应类型 |
| A | 除去O2中的CO | 通入炽热的氧化铜中 | 化合反应 |
| B | 除去CO2中的HCl | 通入饱和碳酸氢钠溶液中 | 中和反应 |
| C | 除去碳酸钙中的碳酸钠 | 溶解、加入氯化钡溶液 | 复分解反应 |
| D | 除去氯化钠中的碳酸钠 | 加入适量盐酸、蒸发 | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
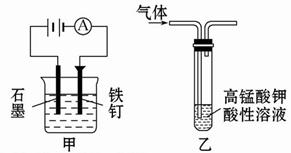
| A.装置甲:防止铁钉生锈 |
| B.测定同温同浓度的NaCl和NaF溶液的pH,确定F、Cl两元素的非金属性的强弱 |
| C.装置乙:除去乙烷中混有的乙烯 |
| D.用Ca(OH)2溶液来鉴别Na2CO3溶液和NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
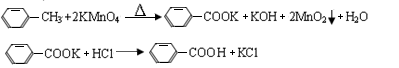
| 名称 | 相对分子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | ∞ | ∞ |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |

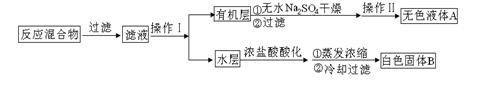
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| Cu | Cu2O | CuO | Cu(OH)2 | CuSO4·5H2O |
| 红色(或紫红色) | 红色(或砖红色) | 黑色 | 蓝色 | 蓝色 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com