
| ①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
| ②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
| ③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
分析 (1)A、B、C、D、E均由短周期元素组成,焰色反应均呈黄色,均含有Na元素,固体化合物A为浅黄色粉末,则是过氧化钠;
(2)根据②③可知F是氯化铁溶液.根据①可知B是Na2S2O3;
(3)Mn2+被氧化生成MnO4-,化合价升高5个单位.氧化剂是X2Y82一,其还原产物是SO42-,1mol氧化剂得到2mol电子,根据电子的得失守恒计算需要氧化剂的物质的;
(4)根据转化可知D是碳酸氢钠,E为碳酸钠,浓硫酸增加的质量就是水的质量,碱石灰增加的质量是CO2的质量,计算水、二氧化碳的物质的量,根据二氧化碳计算碳酸氢钠的物质的量,进而计算E•XH2O的质量,结合生成水的物质的量计算E•XH2O中结晶水的物质的量,再计算E•XH2O中碳酸钠的物质的量,进而确定化学式.
解答 解:(1)A、B、C、D、E均由短周期元素组成,焰色反应均呈黄色,均含有Na元素,固体化合物A为浅黄色粉末,则是过氧化钠,过氧化钠中含有离子键和非极性键,故答案为:AC;
(2)根据②③可知F是氯化铁溶液.根据①可知B是Na2S2O3,B和硫酸反应的方程式为:S2O32-+2H+=S↓+SO2↑+H2O,②属于氢氧化铁胶体的制备,方程式为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl,
故答案为:S2O32-+2H+=S↓+SO2↑+H2O;FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl;
(3)Mn2+被氧化生成MnO4-,化合价升高5个单位.氧化剂是X2Y82一,其还原产物是SO42-,1mol氧化剂得到2mol电子,所以根据电子的得失守恒可知,需要氧化剂的物质的量是$\frac{1mol×5}{2}$=2.5mol,故答案为:2.5mol;
(4)根据转化可知D是碳酸氢钠,E为碳酸钠,浓硫酸增加的质量就是水的质量,物质的量是$\frac{3.42g}{18g/mol}$=0.19mol.碱石灰增加的质量是CO2的质量,所以CO2的物质的量是$\frac{2.2g}{44g/mol}$=0.05mol,则:
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O
0.1mol 0.05mol 0.05mol
因此D(NaHCO3)的物质的量是0.1mol,质量是0.1mol×84g/mol=8.4g.
所以Na2CO3•XH2O的质量是13.04g-8.4g=4.64g,因此Na2CO3•XH2O中结晶水的物质的量是0.19mol-0.05mol=0.14mol,质量是0.14mol×18g/mol=2.52g.所以Na2CO3•XH2O中Na2CO3的质量是4.64g-2.52g=2.12g,其物质的量是$\frac{2.12g}{106g/mol}$=0.02mol,故n(Na2CO3):n(H2O)=0.02mol:0.14mol=1:7,即E•XH20的化学式为Na2C03•7H2O,
故答案为:8.4g;Na2C03•7H2O.
点评 本题考查无机物推断、化学键、方程式书写、氧化还原反应、混合物计算等,难度中等,需要学生具备扎实的基础,是对基础知识的综合应用.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:多选题
| A. | HNO3 | B. | H3 PO4 | C. | H2CO3 | D. | H2 SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
C2H5Cl | C2H5Br | C2H5I | |
密度(g•cm-3) | 0.897 | 1.14 | 1.25 |
沸点(℃) | 12.3 | 38.4 | 42.5 |
| A. | ①③ | B. | ①② | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 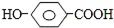 | B. | HO(CH2)2CHO | C. | HOOC-COOH | D. | CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

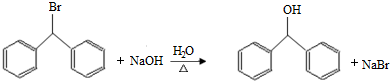 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯中含有少量的苯酚可先加适量的浓溴水,使之生成2,4,6三溴苯酚,再过滤除去 | |
| B. | 将苯酚晶体放入少量水中,加热时全部溶解,冷却到50℃时,溶液仍保持澄清 | |
| C. | 苯酚的酸性很弱,不能使指示剂变色,但可以与NaHCO3溶液反应放出CO2 | |
| D. | 苯酚可以与浓硝酸发生硝化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该有机物分子中不含有氧原子 | B. | 该有机物分子中含一个氧原子 | ||
| C. | 该有机物一个分子中含2个氧原子 | D. | 该物质结构简式为CH3CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com