
现代社会,铁合金可说是金属材料王国的霸主,铁广泛存在于铁的氧化物及多种矿石中,如下表所示:
| 矿石名称 | 磁铁矿 | 黄铁矿 | 赤铁矿 | 黄铜矿 |
| 主要成分 | Fe3O4 | FeS2 | Fe2O3 | CuFeS2 |
请回答下列问题:
(1)在上表所列铁的化合物中,铁元素的质量分数含量最高的是 。
(2)工业上生产硫酸常以硫铁矿为原料,在沸腾炉中加热使硫元素转化为二氧化硫,其反应的方程式为:4FeS2+11O2![]() 2Fe2O3+8SO2,该反应中被氧化的元素是 ,生成1molFe2O3转移电子的物质的量为 mol。
2Fe2O3+8SO2,该反应中被氧化的元素是 ,生成1molFe2O3转移电子的物质的量为 mol。
(3)生产硫酸的工业尾气中含有大量的SO2,若直接排放到大气中造成环境污染的后
果是 ,处理该尾气则可得到一种有价值的盐,请写出该盐的名称 。
(4)据统计,地球上每年由于腐蚀而消耗的铁约占铁的年产量的10%,铁发生腐蚀的主要原因是 (填写下面选项的序号)。
a. 直接与氧气发生了化学腐蚀
b. 通过原电池发生电化学腐蚀
c.与酸雨发生反应而消耗
若你选定选项a或c,请写出相应的化学方程式 ; 若
你选定选项b,请写出负极的电极反应式 。
(1)磁铁矿(或Fe3O4) (2)Fe、S (3分); 22 (3)形成酸雨 ;硫酸铵 (4)b ;Fe-2e-=Fe2+ (除标注外,每空2分)
(1)四种铁的化合物中采用“改写化学式”的巧算方法易知Fe3O4中Fe的质量分数
最高;(2)在4FeS2+11O2![]() 2Fe2O3+8SO2中,物质FeS2中Fe由+2价升到+3价;S由-1价升
2Fe2O3+8SO2中,物质FeS2中Fe由+2价升到+3价;S由-1价升
到+4价,两种元素均被氧化,氧化剂只有O2,该反应转移电子的物质的量为11mol×4,所以
生成1molFe2O3转移电子的物质的量为22mol.(3)SO2排入空中会引起酸雨,工业上一般采
用氨水吸收生成亚硫酸铵,其在空中被氧化成:硫酸铵。
(4)Fe的腐蚀主要是Fe与Fe中含有的碳粒形成原电池发生电化学腐蚀,其中Fe做负极发生氧化反应,生成Fe2+。


科目:高中化学 来源: 题型:阅读理解
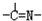 三种基团,无环状结构,三种基团的数目关系为n3=
三种基团,无环状结构,三种基团的数目关系为n3=

查看答案和解析>>
科目:高中化学 来源:2014届甘肃省高一5月月考化学试卷(解析版) 题型:填空题
(10分)古代的炼金术士们认为通过高温炼制可将某些廉价的金属转化为贵重金属银或金,并在实际操作中得到了貌似黄金的“药金”。操作方法是将炉甘石(含ZnCO3)、赤铜(含Cu2O)和木炭混合加热。已知多数碳酸盐受热分解为两种氧化物。
(1)写出上述制取“药金”过程的有关化学方程式:________________________________________________________________
(2)“药金”的主要成分是_______________,根据现代化学观点,你认为“通过高温炼制可将某些廉价的金属转化为贵重金属银或金”的想法可以实现吗?___________,理由是__________________________________________
(3)现代社会中还不时有人被用“药金”制成的“金元宝”、“金首饰”等欺骗而造成巨大损失,如果是你面对这种情况,如何用较简单的方法来确定它是假的“金元宝”、“金首饰”_______________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
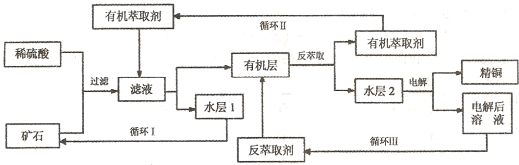
现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(Si02) ,现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进人有机层的过程)和反萃取(铜从有机层进人水层的过程)是现代湿法炼铜的重要工艺手段。

已知:①Cu2O+2H+=Cu2++Cu + H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;③反萃取后的水层2是硫酸铜溶液。回答下列问题:
(1)矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu + H2O、
、 。(写出其中2个)
(2)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体.若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层l暴露在空气中发生反应的离子方程式 。
(3)“循环n”中萃取剂是一类称作为肟类的有机化合物,如N-510、N-530等。某肟类化合物A的分子结构中仅含n1个-CH3、n2个-OH和n3个![]() 三种基团,无环状结构,三种基团的数目关系为n3= 。若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是 。
三种基团,无环状结构,三种基团的数目关系为n3= 。若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是 。
(4)写出电解过程中阳极(惰性电极)发生反应的电极反应式 。
(5)该工艺最大亮点是它符合下列原理 (填字母,下同)。
A.化学平衡 B.绿色化学 C.质量守恒 D.能量守恒
E.相似相溶 F.酸碱中和 G.氧化还原反应
(6)铜、银、金是人类认识最早的三种金属,因为很早就被人们用作钱币,因而有“货币金属”之称。由于铁的金属性比铜、银、金强,相对而言,人类认识铁稍晚。某研究性学习小组为了证明铁的金属活动性比铜强,他设计了如下方案:①铁片置于硫酸铜溶液中有铜析出;②铁、铜和氯气反应分别生成FeCl3和CuCl2;③足量的铁粉和铜粉和浓硫酸反应生成FeSO4和CuSO4;④铜片置于FeCl3溶液中铜片逐渐溶解;⑤把铁片和铜片置于盛有稀硫酸的烧杯中,交用导线连接,铁片上无气泡产生,而铜片上有气泡产生;⑥把铁片和铜片置于盛有浓硝酸的烧杯中,并用导线连接,铁片上有气泡产生,而铜片上无气泡产生。以上设计合理的有 。
A.两种方案 B.三种方案 C.四种方案 D.五种方案
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com